
【题目】向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为( )
A.7.84L
B.6.72L
C.4.48L
D.无法计算
【答案】A
【解析】解:向18.4g铁和铜组成的合金中加入过量的硝酸溶液,反应生成了铁离子和铜离子,加入足量氢氧化钠溶液生成的沉淀为Fe(OH)3、Cu(OH)2 , 则氢氧化铁和氢氧化铁中含有的氢氧根离子的质量为:30.3g﹣18.4g=11.9g,氢氧根离子的物质的量为:n(OH﹣)= ![]() =0.7mol; Cl2与铜、铁反应产物为:FeCl3、CuCl2 , 根据化合物总电荷为0可知,FeCl3、CuCl2中n(Cl﹣)=Fe(OH)3、Cu(OH)2中n(OH﹣),即n(Cl﹣)=0.7mol,根据质量守恒,消耗Cl2的物质的量为:n(Cl2)=
=0.7mol; Cl2与铜、铁反应产物为:FeCl3、CuCl2 , 根据化合物总电荷为0可知,FeCl3、CuCl2中n(Cl﹣)=Fe(OH)3、Cu(OH)2中n(OH﹣),即n(Cl﹣)=0.7mol,根据质量守恒,消耗Cl2的物质的量为:n(Cl2)= ![]() n(Cl﹣)=0.35mol,标况下0.35mol氯气的体积为:22.4L/mol×0.35mol=7.84L,
n(Cl﹣)=0.35mol,标况下0.35mol氯气的体积为:22.4L/mol×0.35mol=7.84L,
故选A.
根据硝酸过量可知,反应产物为铁离子和铜离子,加入氢氧化钠溶液后得到的沉淀为氢氧化铁、氢氧化铜,沉淀质量与铁、铜合金的质量差为氢氧根离子质量,据此可以计算出氢氧根离子的物质的量;铁、铜与氯气反应生成氯化铁、氯化铁,氯化铁和氯化铁中含有的氯离子的物质的量一定等于氢氧根离子的物质的量,据此计算出氯离子的物质的量、氯气的物质的量及标况下氯气的体积.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图2.已知锌的熔点420℃、沸点906℃.则下列说法错误的是( ) 
A.“泥封”的目的是为了防止得到的锌被氧化
B.“锌火”是锌蒸气和一氧化碳在空气的燃烧
C.冶炼时锌变为蒸气在兜室冷凝为固体
D.升炼倭铅过程包含分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,3.2 g O3所含电子数为1.2 NA
B.标准状况下,2.24 L CCl4中含有的C﹣Cl键的数目为0.4 NA
C.标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2 NA
D.将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中逐滴加入稀盐酸
D.硫酸中逐滴加入氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按熔点由低到高的顺序排列正确的是
A. O2、I2、HgB. NH3、PH3、AsH3C. Na、K、RbD. Na、Mg、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42﹣ .
Ⅰ某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答:
(1)反应①的离子方程式为 .
(2)操作①中用到的玻璃仪器是(填序号).
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是(填名称).
(4)原料②的名称为 .
(5)Ⅱ回收的铜可用于制备胆矾(CuSO45H2O).,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
①请分析2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
②用双线桥标出上述反应的电子得失 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则
(1)溶液中一定含有的阳离子有 , 一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为molL﹣1和molL﹣1 . 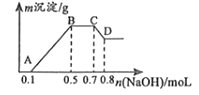
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3
D.2Na2O2+2CO2═2Na2CO3+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( ) 
A.碱洗目的是除去铝材表面的自然氧化膜:2OH﹣+Al2O3═2AlO2﹣+H2O
B.碱洗时铝材表面会出现气泡:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
C.获得耐蚀铝材的电极反应为:4Al﹣12e﹣+3O2═2Al2O3
D.用稀氨水洗去耐蚀铝材表面的酸:NH3H2O+H+═NH4++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com