
| A£® | Ąė×ӵĻ¹ŌŠŌĒæČõ£ŗFe2+£¾Br-£¾Cl- | |
| B£® | µ±ĀČĘųÉŁĮæŹ±£¬·¢ÉśµÄĄė×Ó·“Ó¦£ŗ2Fe2++Cl2ØT2Fe3++2Cl- | |
| C£® | µ±a=bŹ±£¬·“Ó¦ŗóČÜŅŗµÄĄė×ÓÅØ¶Č£ŗc£ØFe3+£©£ŗc£ØBr-£©£ŗc£ØCl-£©=1£ŗ2£ŗ2 | |
| D£® | µ±ĀČĘų¹żĮæŹ±£¬·¢ÉśĄė×Ó·“Ó¦£ŗ2Fe2++4Br-+3Cl2ØT2Fe3++2Br2+6Cl- |
·ÖĪö »¹ŌŠŌFe2+£¾Br-£¬Ź×ĻČ·¢Éś·“Ó¦£ŗ2Fe2++Cl2=2Fe3++2Cl-£¬Fe2+·“Ó¦Ķź±Ļ£¬ŌŁ·¢Éś·“Ó¦£ŗ2Br-+Cl2=2Cl-+Br2£¬a molµÄFeBr2ČÜŅŗÖŠŗ¬ÓŠamolFe2+”¢2amolBr-£¬
A£®Ńõ»ÆŠŌŌ½Ē棬ĻąÓ¦Ąė×ӵĻ¹ŌŠŌŌ½Čõ£»
B£®ĀČĘųÉŁĮæŹ±£¬Ö»ÓŠŃĒĢśĄė×Ó±»Ńõ»Æ£»
C£®µ±a=bŹ±£¬ÓÉ2Fe2++Cl2=2Fe3++2Cl-æÉÖŖ£¬amolFe2+ĻūŗÄ0.5amolCl2£¬Éś³ÉamolFe3+”¢amolCl-£¬ÓÉ2Br-+Cl2=2Cl-+Br2æÉÖŖ£¬0.5amolCl2£¬ĻūŗÄamolBr-£¬ÓÖÉś³ÉamolCl-£¬ČÜŅŗÖŠŹ£ÓąBr-ĪŖamol£»
D£®ĀČĘų¹żĮæŹ±£¬ŃĒĢśĄė×ÓŗĶäåĄė×Ó¶¼ĶźČ«±»Ńõ»Æ£®
½ā“š ½ā£ŗ»¹ŌŠŌFe2+£¾Br-£¬Ź×ĻČ·¢Éś·“Ó¦£ŗ2Fe2++Cl2=2Fe3++2Cl-£¬Fe2+·“Ó¦Ķź±Ļ£¬ŌŁ·¢Éś·“Ó¦£ŗ2Br-+Cl2=2Cl-+Br2£¬a molµÄFeBr2ČÜŅŗÖŠŗ¬ÓŠamolFe2+”¢2amolBr-£¬
A£®Ńõ»ÆŠŌŌ½Ē棬ĻąÓ¦Ąė×ӵĻ¹ŌŠŌŌ½Čõ£¬¹ŹĄė×ӵĻ¹ŌŠŌĒæČõ£ŗFe2+£¾Br-£¾Cl-£¬¹ŹAÕżČ·£»
B£®µ±ĀČĘųÉŁĮæŹ±£¬Ö»ÓŠFe2+±»ĀČĘųŃõ»Æ£¬·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗ2Fe2++Cl2=2Fe3++2Cl-£¬¹ŹBÕżČ·£»
C£®µ±a=bŹ±£¬ÓÉ2Fe2++Cl2=2Fe3++2Cl-æÉÖŖ£¬amolFe2+ĻūŗÄ0.5amolCl2£¬Éś³ÉamolFe3+”¢amolCl-£¬ÓÉ2Br-+Cl2=2Cl-+Br2æÉÖŖ£¬0.5amolCl2£¬ĻūŗÄamolBr-£¬ÓÖÉś³ÉamolCl-£¬ČÜŅŗÖŠŹ£ÓąBr-ĪŖamol£¬·“Ó¦ŗóµÄĄė×ÓÅØ¶Č£ŗc£ØFe3+£©£ŗc£ØBr-£©£ŗc£ØCl-£©=a£ŗa£ŗ2a=1£ŗ1£ŗ2£¬¹ŹC“ķĪó£»
D£®ĀČĘų¹żĮæŹ±£¬ŃĒĢśĄė×ÓŗĶäåĄė×Ó¶¼ĶźČ«±»Ńõ»Æ£¬·¢ÉśĄė×Ó·“Ó¦ĪŖ£ŗ2Fe2++4Br-+3Cl2ØT2Fe3++2Br2+6Cl-£¬¹ŹDÕżČ·£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦¼ĘĖć”¢Ąė×Ó·½³ĢŹ½ŹéŠ“µČ£¬ĢāÄæÄѶČÖŠµČ£¬¹Ų¼üŹĒĆ÷Č·Ąė×Ó·¢Éś·“Ó¦µÄĻČŗóĖ³Šņ£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪöÄÜĮ¦¼°Įé»īÓ¦ÓĆÄÜĮ¦£®


 ÓäæģµÄŗ®¼ŁÄĻ¾©³ö°ęÉēĻµĮŠ“š°ø
ÓäæģµÄŗ®¼ŁÄĻ¾©³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Cl2ÓėH2O·“Ó¦£ŗCl2+H2OØT2H++Cl-+ClO- | |
| B£® | FeÓėĻ”ĮņĖį·“Ó¦£ŗFe+2H+ØTFe3++H2”ü | |
| C£® | °±Ė®ÓėFeCl3ČÜŅŗ·“Ó¦£ŗ3OH-+Fe3+ØTFe£ØOH£©3”ż | |
| D£® | NaOHÓėŃĪĖį·“Ó¦£ŗOH-+H+ØTH2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
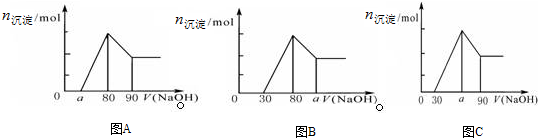
| A£® | AĶ¼ÖŠaµÄȔֵ·¶Ī§ĪŖ 0”Üa£¼50 | |
| B£® | AĶ¼ÖŠ$\frac{n£ØMg£©}{n£ØAl£©}$µÄ×ī“óÖµĪŖ2.5 | |
| C£® | Čō½«¹ŲĻµĶ¼øÄĪŖBĶ¼Ź±£¬ŌņaµÄȔֵ·¶Ī§ĪŖ80£¼a£¼90 | |
| D£® | Čō½«¹ŲĻµĶ¼øÄĪŖCĶ¼Ź±£¬ŌņaµÄȔֵ·¶Ī§ĪŖ75£¼a£¼90 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹¤ŅµæɲÉÓĆ»š·ØĮ¶Ķ£ŗCu2S+O2ØT2Cu+SO2 ĆæÉś³É2molĶ£¬·“Ó¦¹²×ŖŅĘ6NAøöµē×Ó | |
| B£® | ±ź×¼×“æöĻĀ£¬11.2L¼×±½ŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.5NA | |
| C£® | 20gÖŲĖ®£ØD2O£©Ėłŗ¬µÄµē×ÓŹżĪŖ10NA | |
| D£® | 60gSiO2ÖŠ¹²ÓƵē×Ó¶ŌŹżÄæĪŖ4NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ČēĶ¼ĪŖŹµŃéŹŅijÅØŃĪĖįŹŌ¼ĮĘæ±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż£¬ŹŌøł¾Ż±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż»Ų“šĻĀĮŠĪŹĢā£ŗ
ČēĶ¼ĪŖŹµŃéŹŅijÅØŃĪĖįŹŌ¼ĮĘæ±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż£¬ŹŌøł¾Ż±źĒ©ÉĻµÄÓŠ¹ŲŹż¾Ż»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | KOHČÜŅŗ | B£® | K2SO4ČÜŅŗ | C£® | K2CO3ČÜŅŗ | D£® | ŃĪĖįČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com