
| A、二种 | B、三种 | C、四种 | D、五种 |


 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
| A、含有共价键的化合物必是共价化合物 |
| B、阴、阳离子间通过静电引力所形成的化学键是离子键 |
| C、液态氯化氢中存在H+和Cl-,所以能导电 |
| D、化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
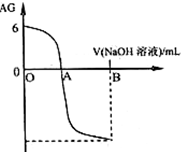 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol?L-1的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
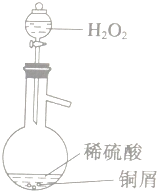
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.某中和滴定实验过程如下:
I.某中和滴定实验过程如下:| 滴定序号 | 待测液体积(mL) | 所消耗盐酸体积(mL)(滴定前) | 所消耗盐酸体积(mL)(滴定后) | 所消耗盐酸体积(mL) |
| 1 | 25.00 | 0.50 | 25.12 | 24.62 |
| 2 | 25.00 | |||
| 3 | 25.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:
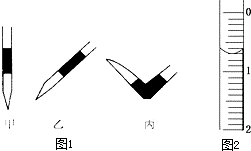 使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.
使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.滴定次数 实验数据/mL | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.80 | 15.00 | 15.02 | 14.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com