
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 铁器在潮湿的空气中生锈 | D. | NaHCO3转化为Na2CO3 |
分析 A、微粒向浓度低的方向扩散;
B、冰的熔点为0°C,水常温是液体;
C、铁在潮湿的空气中生锈是发生了电化腐蚀;
D、碳酸氢钠受热分解生成碳酸钠、水、二氧化碳.
解答 解:A、红墨水浓度大于水,微粒向浓度低的方向分散是自发进行的物理变化,故A不符合;
B、冰的熔点为0°C,水常温是液体,冰在室温下融化成水,是自发进行的物理变化;故B不符合;
C、铁在潮湿的空气中生锈是发生了电化腐蚀,发生了吸氧腐蚀,是自发进行的变化,故C不符合;
D、NaHCO3转化为Na2CO3 是需要一定条件或试剂实现转化,变化过程不是自发进行的变化,故D符合.
故选D.
点评 本题考查了自发进行的变化过程判断,注意理解自发进行的过程和自发进行的反应不同,题目较简单.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)有下列五种烃:
(1)有下列五种烃: ②
② ③乙烷 ④C(CH3)4⑤
③乙烷 ④C(CH3)4⑤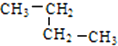 ,其中互为同分异构体的是②④(填序号),②与⑤
,其中互为同分异构体的是②④(填序号),②与⑤ ,E的结构简式为
,E的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通玻璃和钢化玻璃的成分不一样,钢化玻璃中加了玻璃钢 | |
| B. | 水泥的主要成分是硅酸二钙、硅酸三钙和铝酸三钙 | |
| C. | 水泥具有水硬性,因此在保存和运输过程中要注意防水防潮 | |
| D. | 陶瓷的釉料在烧制时,若空气过量,一般显示的是高价态的金属的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液仍为紫色 | |
| B. | 溶液中有气泡产生,溶液最终变为无色 | |
| C. | 最终溶液褪色,而无其他现象 | |
| D. | 溶液最终变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与盐酸 Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液 Ba(OH)2溶液与Na2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液 Na2CO3溶液与NaHSO4溶液 | |
| D. | 石灰石与硝酸 生石灰与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )| A. | 亚氯酸钠在酸性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | pH越大,该漂白剂的漂白性能越好 | |
| D. | 25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com