
【题目】25℃时,向盛有50mLpH=2的HA溶液的绝热容器中加入pH =13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
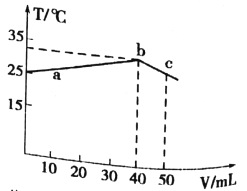
A. a→b 的过程中,混合溶液中可能存在:c(A-)=c(Na+)=c(H+) =c(OH-)
B. HA的物质的量浓度为0.01mol/L
C. b点时,溶液中存在:c(Na+)>c(A-)>c(OH-)>c(H+)
D. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
【答案】C
【解析】A.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,存在:c(A-)=c(Na+)>c(H+)=c(OH-),不可能出现c(A-)=c(Na+)=c(H+)=c(OH-),故A错误;B、恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠=0.04L×0.1mol/L=0.004mol,得出50mlHA的浓度=![]() =0.08mol/L,故B错误;C. b点时恰好中和,溶质为NaA,水解显碱性,溶液中存在: c(Na+)>c(A-)>c(OH-)>c(H+),故C正确;D.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应,溶液温度降低,故D错误;故选C。
=0.08mol/L,故B错误;C. b点时恰好中和,溶质为NaA,水解显碱性,溶液中存在: c(Na+)>c(A-)>c(OH-)>c(H+),故C正确;D.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应,溶液温度降低,故D错误;故选C。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]镁与铝、锰形成的合金广泛应用于航天、运输、化工等领域。回答下列问题:
(1)基态Mn2+核外电子排布式为_________________。
(2)下列各项比较中,Mg>Al的是____________(填选项序号)。
A.电负性 B.金属键的强弱 C.金属性 D.基态原子第一电离能
(3)叶绿素是以镁离子为中心的卟啉配合物,其结构如图。

①Mg2+与N原子形成的化学键为配位键的是__________(填“a”或“b”)。
②叶绿素分子中C原子的杂化轨道类型有______________。
(4)MgO具有NaCl型结构(如图),MgO晶体的熔点比NaCl高的原因是________________;其中阴离子采用面心立方最密堆积方式,阴离子的配位数为___________,r(O2-)=0.148mm,MgO的密度为___________g/cm3(NA表示阿伏加德罗常数的值,列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PH3 是一种无色剧毒气体.下列判断错误的是( )
A.PH3 分子是非极性分子
B.PH3分子中有一对电子孤对
C.PH3 分子VSEPR模型的名称是四面体
D.PH3 分子稳定性低于 NH3 分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.Al2(SO4)3=3Al3++2SO42-B.Ba(HCO3)2=Ba2++2H++CO32-
C.Ca(NO3)2 =Ca2++NO32-D.Ca (OH)2=Ca2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能发生消去反应且产物只有一种的是 ( )
A.CH3CHICH2 CH3 B.CH3OH C.(CH3)3COH D.(CH3)3C—CH2C1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中,正确的是( )
A. 非金属元素组成的化合物中只含共价键
B. 不同元素的原子构成的分子只含极性共价键
C. 熔融状态下能够导电的化合物中存在离子键
D. 单质分子中均存在化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸、
⑨葡萄糖,它们都是常见的重要化工原料。
(1)上述物质中,氢元素的质量分数最大的是________(填分子式);
(2)分别写出⑦、⑧中所含官能团的名称__________、___________,
二者发生酯化反应的化学方程式______________________________________,
如果用4.6 g乙醇和9.0 g乙酸充分反应制得乙酸乙酯5.28 g,则本实验的产率是:__________(产率指的是目标生成物的实际产量与理论产量的比值)。
(3)上述物质中,能发生加成反应的烃类物质有:_______________(填序号)。
(4)下列物质中,不能通过乙烯加成反应得到的是____(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(5)聚氯乙烯,简称PVC,这种材料如果用于食品包装,它对人体的安全性有一定的影响,写出生产聚氯乙烯的化学方程式:__________________________
(6)苯、甲苯、二甲苯是用途广泛的有机溶剂。二甲苯的结构有______种,其中一种被称为“PX”,它的一氯代物只有两种,则“PX”的结构简式是______________。
(7)写出乙醇催化氧化反应的化学方程式 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
(1)岩脑砂的制备
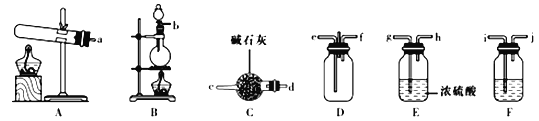
①该实验中用依盐酸与MnO2反应制取所需氯气,则装置F中的试剂是______(填试剂名称)。
②为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:___→ef←____(用小写字母和箭头表示,箭头方向与气流方向一致)。________________
③装置D处有两个明显的不足之处,请指出________________________________。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要_________________________________。
(2)岩脑砂中元素的测定准确称取ag岩脑砂,与足量的氧化铜混合加热(发生的反应为2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
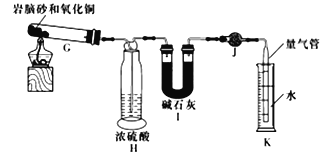
①设置装置H的目的是_____________________________________________。
②若装置I增重bg,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则岩脑砂中m(N):m(Cl)=________ (用含b、V的代数式表示,不必化简)。
若测量体积时气体温度高于常温(其他操作均正确),则m(N)比正常值____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com