

| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
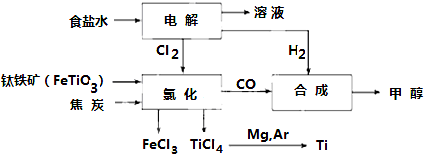
分析 钛铁矿中加入强酸,强酸性浸出液中含有TiO2+、Fe2+、Fe3+、Al3+等,①中加入铁屑至浸出液显紫色,此时溶液呈强酸性,该过程中有如下反应发生:2Fe3++Fe=3Fe2+;2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O,通过一系列过程得到绿矾FeSO4.7H2O和含有TiO2+溶液,将溶液处理得到TiO2•nH2O,将粗TiO2和氯气、焦炭混合加热得到TiCl4,发生反应TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO,得到的废气是SO2,
(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+;
(2)控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm);
(3)根据上面的分析可知,④中TiO2和焦炭、氯气反应生成TiCl4和CO;
(4)绿色化学应零污染、零排放,原子利用率100%.结合工艺流程三废回答;
(5)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,通常采取蒸馏方法分离.
解答 解:钛铁矿中加入强酸,强酸性浸出液中含有TiO2+、Fe2+、Fe3+、Al3+等,①中加入铁屑至浸出液显紫色,此时溶液呈强酸性,该过程中有如下反应发生:2Fe3++Fe=3Fe2+;2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O,通过一系列过程得到绿矾FeSO4.7H2O和含有TiO2+溶液,将溶液处理得到TiO2•nH2O,将粗TiO2和氯气、焦炭混合加热得到TiCl4,发生反应TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO,得到的废气是SO2,
(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+,加入铁屑作还原剂,将Fe3+还原为Fe2+,防止Ti3+被Fe3+氧化成TiO2+,
故答案为:生成Ti3+,保护Fe2+不被氧化;
(2)控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm),
故答案为:10-9~10-7m(或1nm-100nm);
(3)根据上面的分析可知,④中反应方程式为TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;
(4)由工艺流程可知,生成中产生废气,废液,废渣等,不符合绿色化学理念,
故答案为:产生了废气,废液,废渣等;
(5)由表中数据可知,SiCl4、TiCl4为液体,二者沸点相差较大,要精制含少量SiCl4杂质的TiCl4,可采用蒸馏(或分馏)方法,
故答案为:蒸馏(或分馏).
点评 本题考查学生阅读题目获取信息能力、氧化还原反应、绿色化学、胶体、物质分离提纯等,难度不大,注意基础知识的掌握利用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| X | 所有元素中原子半径最小的元素 |
| Y | 地壳中含量最多的元素 |
| Z | 短周期中原子半径最大的金属元素 |
| M | 与Y同主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| c(H+) | c(SO42-) | c(Fe2+、Fe3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 环境问题 | 造成环境问题的主要物质 |
| 温室效应 | |
| 酸雨 | |
| 南极臭氧层空洞 | |
| 光化学烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com