

 2Fe2O3+4CO2(2分)
2Fe2O3+4CO2(2分)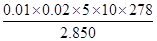 =0.9754。④a项,锥形瓶内有水对结果无影响,b项,滴定管未润洗相当于将标准液稀释,所用标准液体积增大,故结果偏高;c项,终点时产生气泡,读取体积偏小,结果偏低;d项,取待测液结束时俯视导致所取待测液体积偏大,消耗标准液体积偏大,结果偏高。
=0.9754。④a项,锥形瓶内有水对结果无影响,b项,滴定管未润洗相当于将标准液稀释,所用标准液体积增大,故结果偏高;c项,终点时产生气泡,读取体积偏小,结果偏低;d项,取待测液结束时俯视导致所取待测液体积偏大,消耗标准液体积偏大,结果偏高。

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验步骤 | 实验操作 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
 2Fe2O3+4CO2
2Fe2O3+4CO2查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验方法 | 实验现象 | 结论 |
| ①向R溶液中 加KSCN溶液 | | 固体物质中有FeCl3 |
| ②向R溶液中滴加 酸性KMnO4溶液 | | 固体物质中不含FeCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
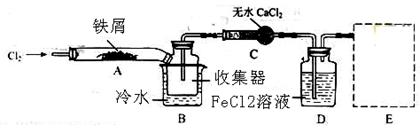
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
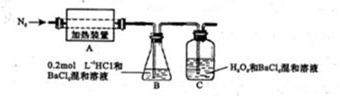
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.4g | B.3.2g | C.6.4g | D.9.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com