
【题目】已知反应:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化率随时间变化的关系曲线(Yt)如下图所示。下列说法正确的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化率随时间变化的关系曲线(Yt)如下图所示。下列说法正确的是
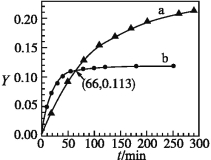
A.b代表0 ℃下CH3COCH3的Yt曲线
B.反应进行到20 min末,CH3COCH3的![]() >1
>1
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的![]() =1
=1
科目:高中化学 来源: 题型:
【题目】下列情况会对人体健康造成较大危害的是( )
A.自来水中通入少量Cl2进行消毒杀菌
B.用SO2漂白食品
C.用食醋清洗热水瓶胆内壁附着的水垢
D.用小苏打(NaHCO3)发酵面团制作馒头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理方法正确的是( )
A. 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
B. 制取并用排水法收集氧气结束后,应立即停止加热
C. 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D. 浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氧化还原反应的理解正确的是( )
A. 在一定条件下,氯酸钾与碘发生反应KClO3+I2=2KIO3+Cl2 由此判断氧化性 I2>Cl2
B. 已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O其中1mol氧化剂在反应中得到的电子为12 mol
C. (NH4)2SO4在高温下分解生成 SO2、H2O、N2和 NH3。则该反应的氧化产物:还原产物=1:3
D. 在反应2CuFeS2 + O2 = Cu2S + 2FeS + SO2中,若有1molO2参加反应,则反应中有4mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究非元素及其化合物的性质具有重要意义。
Ⅰ. 含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2 。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测定烟气中SO2的体积分数。
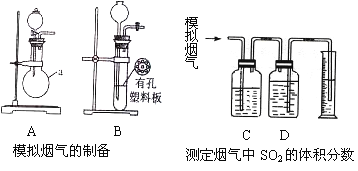
(一)模拟烟气的制备
(1)用A装置制SO2,化学反应方程式为___________________________。
(2)用B装置制CO2,使用该装置优点的是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
(二)测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是__________、__________。(填序号)
①KMnO4溶液 ②饱和NaHSO3溶液 ③饱和Na2CO3溶液 ④饱和NaHCO3溶液
(5)若模拟烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数____________________。
Ⅱ.某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹) 。
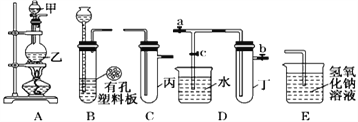
(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。①若在丙中加入适量水,即可制得氯水。将所得氯水进行实验,实验操作、现象、结论如下:
实验操作 | 现 象 | 结 论 |
氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气和水反应的产物具有酸性 |
实验的结论是否合理__________,(选填合理或不合理)请说明理由______________________。
②请利用上述装置设计一个简单的实验验证Cl-和S2-的还原性强弱,则甲、乙、丙中盛放的试剂是甲__________________ 乙__________________ 丙__________________
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是:___________________________________使试管中的气体逸出,NO2与水接触后即可引发烧杯中的水进入试管丁。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水的生理功能的叙述中,不正确的是
A. 自由水是良好的溶剂
B. 水溶液可运输代谢废物到排泄器官
C. 结合水是细胞结构的重要组成成分
D. 水参与代谢时能提供能量供生命活动需要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为番茄电池的示意图,下列说法正确的是( ) 
A.电流由锌通过导线流向铜
B.负极反应为Zn﹣2e﹣=Zn2+
C.一段时间后,铜片质量会减少
D.一段时间后,锌片质量会增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下: 
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
III.Sn(OH)2的性质与Al(OH)3性质相似。 请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是_________________;
(2)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子方程式是 ________________;
(3)在反应Ⅰ得到沉淀SnO后,要进行“过滤、漂洗”的操作,检验SnO是否洗干净的操作是_______,滤液I溶质的成分是______(填写化学式)。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是_______________;
(5)反应Ⅱ之后的“操作”依次是_______、_______、过滤、洗涤、低温干燥。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2+ H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+ K2Cr2O7+ 14HCl =6FeCl3+ 2KCl + 2CrCl3+7H2O,取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com