
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
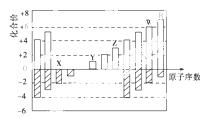
A.原子半径:Z>Y>X
B.气态氢化物的稳定性R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
科目:高中化学 来源: 题型:
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153ºC)与氢氧化铁制得。其结构如右图。
(1)柠檬酸的晶体类型为 。
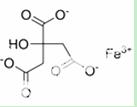 (2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(3)柠檬酸铁所含非金属元素,电负性从小到大的顺序为
(填元素符号)。
(4)柠檬酸铁中,碳原子的杂化轨道类型为 。
(5)I2(Fe) I3(Fe)(填“>”或“<”)。
(6)柠檬酸铁溶液中不存在的微粒间作用力为 (填序号)。
A.离子键 B.极性键 C.非极性键
D.金属键 E.氢键 F.范德华力
(7)H3O+中H-O-H键角比H2O中H-O-H键角大,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知:
A(s)+B(g)====C(g)+D(g) ΔH=+131.4 kJ·mol-1,
某同 学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
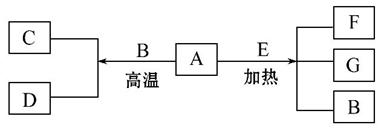
(1) 写出A元素的名称________。
写出A元素的名称________。
(2)另外知:A(s)+O2(g)====G(g) ΔH=-393.6 kJ·mol-1
C(g)+ O2(g)====G(g) ΔH=-283 kJ·mol-1
O2(g)====G(g) ΔH=-283 kJ·mol-1
D(g)+ O2(g)====B(g) ΔH=-242 kJ·mol-1
O2(g)====B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?___________,理由是___[.Com ]
]
____________________________________________________。
(3)写出A+O2→C的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,
其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系: 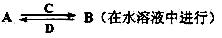
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B 为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为
为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为  。
。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是三种短周期金属元素,原子序数依次增大,单质的物质的量分别为n(X)、n(Y)、n(Z),它们与足量盐酸反应产生的氢气体积(标准状况下)为V(H2)X、V(H2)Y、V(H2)Z,且n( X)=n(Y)=n(Z),2V(H2)X=V(H2)Y+V(H2)Z。下列说法正确的是( )
X)=n(Y)=n(Z),2V(H2)X=V(H2)Y+V(H2)Z。下列说法正确的是( )
A.X、Y、Z一定处于同一周期
B.X可能是镁
C.Y和Z的最高价氧化物对应的水化物在一定条件下能反应
D.工业上冶炼X、Y、Z通常是用热还原法制得
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为________(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>________。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态 化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式__________________________________________。
化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式__________________________________________。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
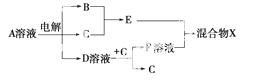
①写出D溶液与G反应的化学方程式_________________________________________
________________________________________________________________________。
②写出检验A溶液中溶质的阴离子的方法:_____________________________________
________________________________________________________________________。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为________mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+ 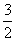 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=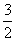 S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+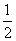 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A.△H4=2/3(△H1+△H2-3△H3)
B.△H4=2/3(3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)
D.△H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去).A 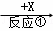 B
B 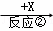 C
C
试回答:
(1)若X为O2,则A不可能是 (填选项).
a.Si b.NH3 c.Mg d.S
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B溶液显碱性的原因 ,举出C的一种用途 .
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式 ,C的水溶液中各离子浓度由大到小顺序为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com