
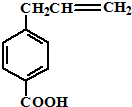
| A. | 该化合物的化学式为C10H11O2 | |
| B. | 分子中所有的碳原子不可能处于同一平面上 | |
| C. | 它的部分同分异构体能发生水解反应时则不能发生消去反应 | |
| D. | 该化合物能与新制的Cu(OH)2溶液发生反应生成砖红色沉淀且苯环上的一氯代物只有一种的同分异构体有4 |
分析 有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有羧基,具有酸性,可发生中和、酯化反应,结合乙烯、苯的结构特点解答该题.
解答 解:A.由结构简式可知有机物分子式为C10H10O2,故A错误;
B.苯环、碳碳双键具有平面形结构,则所有的碳原子可能处于同一平面上,故B错误;
C.能发生水解反应,则含有酯基,此时不含羟基,则不能发生消去反应,故C正确;
D.该化合物能与新制的Cu(OH)2溶液发生反应生成砖红色沉淀且苯环上的一氯代物只有一种,说明分子中应含有2个醛基,且含有两个甲基,可能的结构有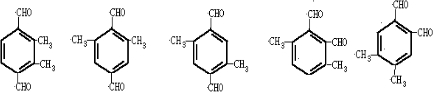 等,故D错误.
等,故D错误.
故选C.
点评 本题考查有机物的结构和性质,为高频考点和常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,易错点为D,注意同分异构体的判断,难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大 | |
| B. | 开发利用绿色能源(例如太阳能)替代化石燃料是人类可持续发展的必由之路 | |
| C. | 装修材料中的苯主要来自胶、漆等,是强致癌物 | |
| D. | 氟氯烃含量是空气质量报告的主要项目之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (直接标在答题卡的相应方程式上).
(直接标在答题卡的相应方程式上).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>C>D | B. | 离子半径:A+>B2+>C->D2- | ||
| C. | 氢化物稳定性:H2D>HC | D. | 金属性:A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | DABC | B. | DCAB | C. | BADC | D. | ABCD |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl是还原产物 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | 每生成1molNa2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
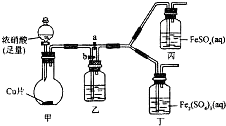 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 产物B的状态只能为固态或液态 | |
| B. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a KJ | |
| D. | 衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com