
 .
.分析 A、B、C、D、E为原子序数依次增大的短周期元素,C元素的最外层电子数比次外层电子数少4,则C元素原子有3个电子层,最外层电子数为4,则C为Si元素;D元素原子序数大于硅元素,处于第三周期,D元素原子次外层电子数比最外层电子数多3,则最外层电子数为8-3=5,则D为磷元素;A、B、E三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,是氢氧化铝、强碱、强酸之间的反应,故A为Na、B为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则E为Cl元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的短周期元素,C元素的最外层电子数比次外层电子数少4,则C元素原子有3个电子层,最外层电子数为4,则C为Si元素;D元素原子序数大于硅元素,处于第三周期,D元素原子次外层电子数比最外层电子数多3,则最外层电子数为8-3=5,则D为磷元素;A、B、E三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,是氢氧化铝、强碱、强酸之间的反应,故A为Na、B为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则E为Cl元素.
(1)由以上分析可知:A为Na,B为Al,C为Si,D为P,E为Cl,故答案为:Na;Al;Si;P;Cl;
(2)A与E两元素可形成化合物为NaCl,用电子式表示其化合物的形成过程为 ,
,
故答案为: ;
;
(3)C为Si,D为P,非金属性P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H3PO4>H2SiO3,
故答案为:H3PO4>H2SiO3.
点评 本题考查原子结构位置与性质关系,综合考查元素周期表、周期律以及原子结构的特点,根据原子结构特点正确推断元素的为解答该题的关键,题目难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和漂白粉作用,生成具有氧化性的物质 | |
| B. | 二氧化硫通入氢硫酸中,使溶液的酸性一定减弱 | |
| C. | 二氧化硫和烧碱反应,使溶液的碱性一定减弱 | |
| D. | 二氧化氮可相互结合为四氧化二氦氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr2+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•4H2O]即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | a=60 | 10 | 30 |
| ② | 5 | 60 | 10 | c=30 |
| ③ | 5 | 60 | b=20 | 20 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反条件与实验①相同,进行对比实验. | 反应进行相同时间后, 若溶液中的Cr2O72-浓度大于 实验①中的Cr2O72的浓度,则假设一成立; 若溶液中的Cr2O72-浓度等于 实验①中的Cr2O72的浓度,则假设一不成立. |
| 组数 | 1 | 2 | 3 | 4 |
| 消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| B. | 对氯甲苯和邻氯甲苯 | |
| C. | 2-甲基丁烷和戊烷 | |
| D. | 甲基丙烯酸和甲酸丙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
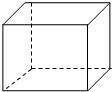 “立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H5OH | C. | C2H4O | D. | C2H4O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com