
【题目】化合物D是一种药物雷洛昔芬的中间体。可以通过以下方法合成:
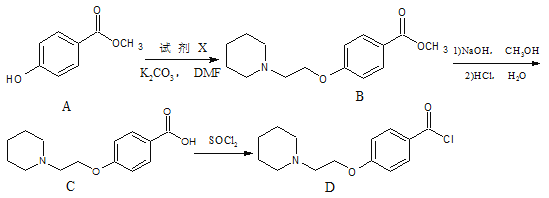
(1)化合物B中的含氧官能团为___________和___________(填官能团名称)。
(2)试剂X的分子式为C7H14NCl,则X的结构简式为____________,C→D的反应类型为____________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式___________。
Ⅰ.氨基(—NH2)与苯环直接相连Ⅱ.能与FeCl3溶液发生显色反应
Ⅲ.分子中有4种不同化学环境的氢
(4)已知:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
请写出以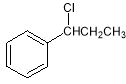 、
、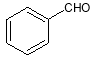 为原料制备
为原料制备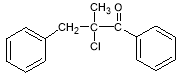 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】【化学──选修2:化学与技术】
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤;
d. 烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是①______________(填序号),配制上述溶液还需用到的玻璃仪器是②____________(填仪器名称)。
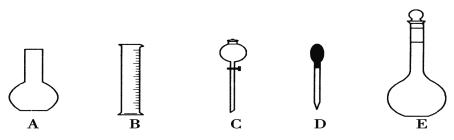
(2)根据计算用托盘天平称取NaOH的质量为③________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度④__________0.1 mol·L-1(填“大于”、“等于”或“小于”)。
(3)由计算知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为⑤________mL(计算结果保留一位小数)。如果实验室有15 mL、20 mL、50 mL量筒,应选用⑥________mL量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下三个热化学方程式:
2H2(g)+O2(g)=2H2O(g) 放热Q1 kJ
2H2(g)+O2(g)=2H2O(l) 放热Q2 kJ
H2(g)+1/2O2(g)=H2O(g) 放热Q3 kJ,其中Q1 Q2 Q3 大小关系是
A.Q1=Q2=Q3 B.2Q3=Q1<Q2
C.Q3<Q2<Q1 D.Q1<Q2<3Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列晶体中含有非极性共价键的离子晶体是( )
①硅晶体 ②H2O2 ③CaC2 ④NH4Cl ⑤Na2O2 ⑥苯酚
A.①②④⑥ B.①③ C.②④⑤⑥ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。

(1)实验时装置A需在60℃~100℃进行的原因是_________,控制所需温度的方法是___________。
(2)电动搅拌棒的作用是_________。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___________________。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式_________________。
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-)。
① ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图
 所示
所示
② 当pH≤2.0时,ClO2-也能被I-还原成Cl-
③ 2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0; ;再重复上述操作1~2次,计算得出结果。
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。

(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是______________。
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-(反应为:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
①已知: Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=__________mol/L。
②计算KClO4样品的纯度(请写出计算过程。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述不正确的是( )
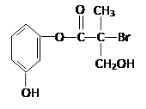
A.该有机物与浓溴水可发生取代反应
B.1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH
C.该有机物与浓硫酸混合共热可发生消去反应
D.该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com