
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |

| △c |
| △t |
| c(H2O)×c(CH3OH) |
| c3(H2)×c(CO2) |
| c(H2O)×c(CH3OH) |
| c3(H2)×c(CO2) |
| △c |
| △t |
| ||
| 5min |


科目:高中化学 来源: 题型:
 有一无色溶液,可能含有Fe3+,Al3+,Mg2+,Cu2+,NH4+,K+,CO32-,SO42-,NO3-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
有一无色溶液,可能含有Fe3+,Al3+,Mg2+,Cu2+,NH4+,K+,CO32-,SO42-,NO3-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:| 主要实验内容 | 现 象 | |
| ① | 焰色反应(透过蓝色钴玻璃) | 紫色火焰 |
| ② | 先加入稀盐酸后加BaCl2溶液 | 无气体产生,但是出现白色沉淀 |
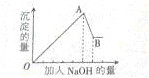
| ③ | 逐滴加入NaOH溶液至过量 | 生成白色沉淀的量与加入NaOH的量的关系如下图所示 |
| ④ | 加入足量Na2O2粉末 | 生成无色无味气体,白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Ca2+的浓度增大 |
| B、溶液中Ca2+的浓度减小 |
| C、溶液中pH不变 |
| D、溶液中pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 | 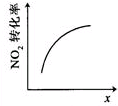 |  | 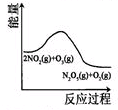 |
| t1时仅加入催化剂,平 衡向正方向移动 | 达平衡时,仅改变x, 则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数 减小 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
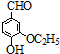 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.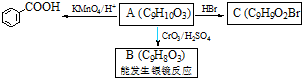
| CrO3/H2SO4 |
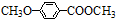 )是一种医药中间体.请设计合理方案用茴香醛(
)是一种医药中间体.请设计合理方案用茴香醛(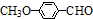 )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).例如:
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).例如:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com