
(1)根据等电子原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:________和________;________和________。
(2)根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO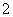 互为等电子体的分子有:________。
互为等电子体的分子有:________。
科目:高中化学 来源: 题型:
据某科学杂志报道,国外有一研究机构发现了一种新的球形分子,它的分子式为C60Si60,其分子结构酷似中国传统工艺“镂雕”,经测定其中包含C60,并且也有Si60结构,下列叙述不正确的是( )
A.该物质有很高的熔点,很大的硬度
B.该物质形成的晶体属于分子晶体
C.该物质分子中C60被包裹在Si60里面
D.该物质的相对分子质量为2 400
查看答案和解析>>
科目:高中化学 来源: 题型:
试回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO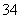 ___________________;
___________________;
CS2_______________。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:

A:______________;B:____________。
(3)按要求写出第2周期非金属元素构成的中性分子的化学式:
平面形分子____________,三角锥形分子________________,四面体形分子
____________。
(4)下列一组微粒中键角由大到小顺序排列为______________(用编号填写)。
①HCN ②SiF4 ③SCl2 ④CO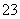 ⑤H3O+
⑤H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
普通玻璃和水晶的根本区别在于( )
A.外形不一样
B.普通玻璃的基本构成微粒无规则性地排列,水晶的基本构成微粒按一定规律做周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.水晶可用于能量转换,普通玻璃不能用于能量转换
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.离子化合物中的阳离子不一定是金属离子
B.阴、阳离子通过静电引力而形成的化学键叫做离子键
C.离子化合物如能溶于水,其水溶液一定可以导电
D.大多数的盐、碱和低价金属氧化物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g),按要求填空。
(1)若所得混合气体对H2的相对密度为d,则混合气体的物质的量为________。NH4HCO3的摩尔质量为________(用含m、d的代数式表示)。
(2)所得混合气体的密度折合成标准状况为ρ g·L-1,则混合气体的平均摩尔质量为________________。
(3)在该条件下,所得NH3、CO2、H2O(g)的体积分数分别为a%、b%、c%,则混合气体的平均相对分子质量为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com