
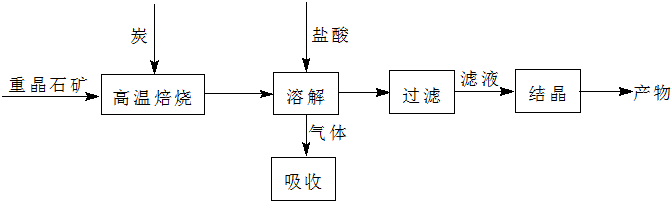
分析 实验室用重晶石(主要成分BaSO4)加入碳高温反应得到BsS,溶于盐酸生成氯化钡溶液和硫化氢气体,BaCl2溶液蒸发浓缩,结晶析出过滤得到晶体,
(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主;
(2)根据溶度积常数计算$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{c(A{g}^{+})}$:$\frac{Ksp(AgCl)}{c(A{g}^{+})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$;
(3)利用盖斯定律计算反应热,BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
将以上两个热化学方程式相减,然后除以2可得:;
(4)加入过量C可提高冰晶石的转化率,同时维持反应进行.
解答 解:(1)Na2S水解呈碱性,且有两步水解,以第一步水解为主,第一步水解生成离子HS-,第二步水解生成H2S,水解的离子方程式分别为S2-+H2O?HS-+OH-;
HS-+H2O?H2S+OH-,故答案为:S2-+H2O?HS-+OH-; HS-+H2O?H2S+OH-;
(2)当两种沉淀共存时,Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=$\frac{Ksp(AgBr)}{c(A{g}^{+})}$,c(Cl-)=$\frac{Ksp(AgCl)}{c(A{g}^{+})}$,则$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{5.4×1{0}^{-13}}{2.0×1{0}^{-10}}$=2.7×10-3.
故答案为:2.7×10-3;
(3)利用盖斯定律求解:
BaSO4(s)+4C(s)$\frac{\underline{\;高温\;}}{\;}$4CO(g)+BaS(s)△H1=571.2kJ•mol-1 ①
BaSO4(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$2CO2(g)+BaS(s)△H2=226.2kJ•mol-1 ②
将以上两个热化学方程式相减,然后除以2可得:
C(s)+CO2(g)$\frac{\underline{\;高温\;}}{\;}$2CO(g)△H=$\frac{571.2KJ/mol-226.2KJ/mol}{2}$=+172.5kJ•mol-1,
故答案为:+172.5;
(4)加入过量C可提高冰晶石的转化率,以上反应为吸热反应,炭和氧气反应放热维持反应所需高温,
故答案为:使BaSO4得到充分的还原(或提高BaS的产量);①②为吸热反应;炭和氧气反应放热维持反应所需高温.
点评 本题考查较为综合,题目具有一定难度,涉及盐类的水解、难溶电解质的溶解平衡、反应热的计算等问题,本题注意溶度积常数的利用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 1 | 2 | 3 | 4 | 5 |
| 每次加入AgNO溶液的体积/mL | 100 | 100 | 100 | 100 | 100 |
| 生成沉淀的质量/g | 71.75 | 143.5 | 215.25 | 287.0 | 287.0 |
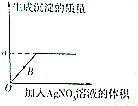 (1)生成沉淀的质量a=287.0g.
(1)生成沉淀的质量a=287.0g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①③ | C. | 只有①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| B. | 通常情况下,32g O2和O3的混合气体含有的分子总数小于NA | |
| C. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| D. | 标准状况下,将分子总数为NA的NH3和Cl2充分混合后,所得混合气体体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ④CH3COOH⑤HOCH2CHO ⑥CH3CH2CH2CH3⑦葡萄糖 ⑧蛋白质⑨淀粉
④CH3COOH⑤HOCH2CHO ⑥CH3CH2CH2CH3⑦葡萄糖 ⑧蛋白质⑨淀粉查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片放入氢氧化钠溶液中:Al+2OH-═AlO${\;}_{2}^{-}$+H2↑ | |
| B. | Na与水反应:Na+2H2O═Na++H2↑+2OH- | |
| C. | 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | AlCl3溶液中滴入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com