
| A. | c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | B. | c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | ||
| C. | c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) | D. | c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
分析 根据溶解度判断沉淀的先后顺序,溶解度小的先生成沉淀,利用溶度积常数计算出各离子浓度,结合反应的程度比较溶液离子浓度的大小.
解答 解:若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL0.01mol/L AgNO3溶液,首先生成AgI沉淀,
反应后剩余n(Ag+)=0.006L×0.01mol/L=6×10-5mol,继续生成AgCl沉淀,
反应后剩余n(Cl-)=0.01×0.01mol/L-6×10-5mol=4×10-5mol,
c(Cl-)=$\frac{4×1{0}^{-5}mol}{0.026L}$=1.53×10-3mol/L,浊液中c(Ag+)═$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{(1.25×1{0}^{-5})^{2}}{1.53×1{0}^{-3}}$=1.02×10-7mol/L,
c(I-)═$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{(1.22×1{0}^{-8})^{2}}{1.02×1{0}^{-7}}$=1.48×10-9mol/L,
混合溶液中n(K+)=2×10-4mol,
n(NO3-)=0.016L×0.01mol/L=1.6×10-4mol,则c(K+)>c(NO3-),
故c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),
故选:B.
点评 本题考查难溶电解制得溶解平衡及溶液中离子浓度大小比较,本题注意溶液中各物质的量计算出剩余c(Cl-),再根据Ksp计算银离子浓度和碘离子浓度,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 含4mol HCl的浓盐酸与足量MnO2混合加热,转移电子数为2NA | |
| B. | 6.4gCu与过量硫粉反应,转移电子数为0.2NA | |
| C. | 通常状况下,112mL水中含有的电子数约为62.2NA | |
| D. | 标况下,2.24LSO3中含有0.1NA个SO3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
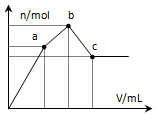 向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol•L-1硫酸铝铵溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A. | a点的溶液呈中性 | |
| B. | 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ | |
| C. | c点加入Ba(OH)2溶液的体积为200 mL | |
| D. | c点溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. |  2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol.L-1的氨水中NH4+、NH3和NH3•H2O的总数为NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 0.1 mol Cu与足量浓硫酸反应生成SO2的体积约为4.48 L | |
| D. | 常温常压下,21g氧气和27 g臭氧所含的氧原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com