
| m |
| n |
| 1 |
| 2 |
| 100ml |
| 50ml |
| m |
| n |
| 4.06g |
| 0.02mol |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
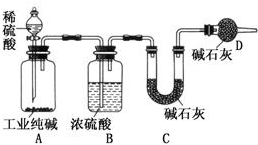 工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:
工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:
 海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.从海水中得到的粗盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入氯化钡、氢氧化钠、碳酸钠等物质(均过量)将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图:
海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质.从海水中得到的粗盐中还含有硫酸钠、氯化镁、氯化钙等可溶性杂质,他们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在,为将这些杂质离子除净,应加入氯化钡、氢氧化钠、碳酸钠等物质(均过量)将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图: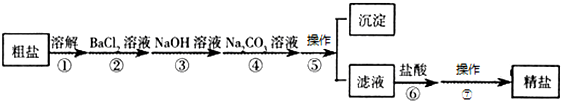
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室配制FeCl3溶液时加入铁粉和稀盐酸 |
| B、为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C、除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 |
| D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
A、
| ||
B、
| ||
| C、7 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑥⑦⑨ |
| B、①②⑤⑥⑧ |
| C、③④⑦⑧⑨ |
| D、①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②⑤ |
| C、②④⑤ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
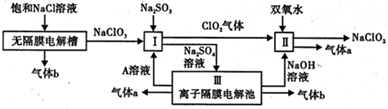
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com