
| A. | 过氧化钠是一种淡黄色固体 | |
| B. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 过氧化钠与水反应后的溶液滴加几滴酚酞溶液,溶液会变为红色 | |
| D. | 1mol过氧化钠与水反应可生成1mol氧气 |
分析 A.过氧化钠是淡黄色固体;
B.过氧化钠能和二氧化碳、水反应生成氧气;
C.过氧化钠和水之间发生反应生成氢氧化钠和氧气;
D.根据过氧化钠和水反应生成氧气的方程式计算.
解答 解:A.过氧化钠是一种淡黄色固体,故A正确;
B.2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,所以过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源,故B正确;
C.过氧化钠和水之间发生反应生成氢氧化钠和氧气,反应后的溶液滴加酚酞,液体会变为红色,故C正确;
D.过氧化钠和水反应生成氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑,则1mol过氧化钠与水反应可生成0.5mol氧气,故D错误;
故选D.
点评 本题考查了钠及其化合物的性质,根据物质的性质分析解答,熟练掌握常见元素化合物知识,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | 糖类、油脂和蛋白质均能水解 | 供给人类营养 |
| B | 铁能被浓硫酸钝化 | 铁制器皿用作铜和浓硫酸的反应容器 |
| C | 碳单质的还原性强于硅单质 | 碳与石英反应冶炼粗硅 |
| D | 常温下,氨气能与氯气反应 | 浓氨水检验氯气管道泄漏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
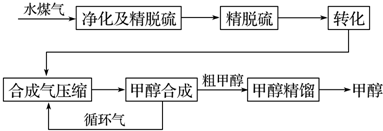
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为3的He原子:32He | B. | HCl的电子式: | ||
| C. | S2-的结构示意图: | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHCO3溶液中加入过量的Na2O2粉末 | |
| B. | 向KI和NaBr混合溶液中通入过量的Cl2 | |
| C. | 向NaAlO2溶液中加入过量的HCl溶液 | |
| D. | 将物质的量相同的(NH4)2SO4溶液和BaCl2溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | |
| C. | 碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使Al3+沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2 Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com