
(1)有pH均为2的a盐酸、b醋酸两瓶溶液,与足量锌反应放出等体积H2所需时间的长短顺序是a____b(用“>”、“<”、“=”表示,下同);完全中和等物质的量的NaOH溶液需两种酸的体积大小顺序是a____b。
(2)已知水在25℃和95℃时,其电离平衡曲线如下图所示:
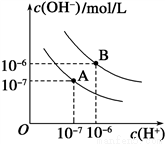
①则25℃时水的电离平衡曲线应为________(填“A”或“B”)。
②95℃时水的离子积KW=___________________。
③25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
④95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_____________。
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:选择题
下列关于元素及其化合物的说法不正确的是
A.Fe在一定条件下可与浓盐酸、稀硫酸、浓硝酸等剧烈反应
B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用不相同
C.在稀硫酸中加入铜粉,铜粉不溶解,若再继续加入KNO3固体,铜粉会溶解
D.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期末化学试卷(解析版) 题型:选择题
铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间 后,发现铜粉质量减少,溶液呈蓝色,同时有气体逸出,该盐可能是( )
后,发现铜粉质量减少,溶液呈蓝色,同时有气体逸出,该盐可能是( )
A.FeC13 B.Na2CO3 C.KNO3 D.FeSO4
D.FeSO4
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:选择题
向10 mL 0.1mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( )
A.x=10时,溶液中有NH 、Al3+、SO
、Al3+、SO 、且c(NH
、且c(NH )=c( SO
)=c( SO )>c(Al3+)
)>c(Al3+)
B.x=15时,溶液中有NH 、SO
、SO ,且c(NH
,且c(NH )<2c(SO
)<2c(SO )
)
C.x=20时,溶液中有NH 、Al3+、OH-,
、Al3+、OH-, 且c(OH-)>c(Al3+)
且c(OH-)>c(Al3+)
D.x=30时,溶液中有Ba2+、AlO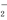 、OH-,且c(OH-)=c(Ba2+)
、OH-,且c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数。下列说法正确的是( )
A.标准状况下, 2.24 L H2O的分子数为0.1NA
2.24 L H2O的分子数为0.1NA
B.0.1 mol Na2O2中含有的阴离子数目为0.2NA
C.4.4 g CO2气体中含有的原子总数为0.3NA
D.1 L 0.1 mol·L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。判断下列说法中,正确的是( )
A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的KW值比b点的KW值大
D. a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团第二师华山中学高二上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是 ( )
A2(g)+B2(g)达到平衡状态的标志是 ( )
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
海藻中含丰富的、以离子形式存在的碘元素。如图是实验室从海藻里提取碘的流程的一部分下列判断正确的是( )
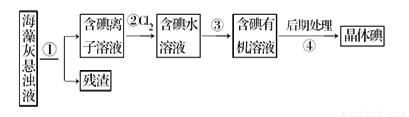
A. 可用淀粉溶液检验步骤②的反应是否进行完全 B. 步骤③中加入的有机溶剂是乙醇
C. 步骤④的操作是过滤 D. 步骤①、③的操作分别是过滤、萃取分液
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:填空题
金属稼是一种广泛用于电子工业和通讯领域的重要金属,稼元素(31Ga)在元素周期表中位于第四周期,IIIA族,化学性质与铝元素相似。
(1)稼元素的原子结构示意图是_______________________。
(2)工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼( GaN)同时又有氢气生成。反应中,每生成3molH2时就会放出30.8kJ的热量。
GaN)同时又有氢气生成。反应中,每生成3molH2时就会放出30.8kJ的热量。
①反应的热化学方程式是________________________;
②反应的化学平衡常数表达式是___________________,温度升高时,反应的平衡常数_____________(填“变大”“变小”或“不变”);[
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是__________
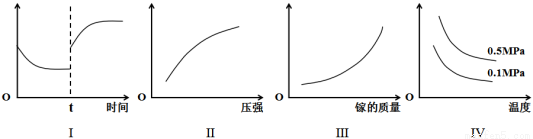
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.IV图像中纵坐标可以为体系内混合气体平均相对分子质量
(3)工业上提纯镓的方法很多,其中以电解精炼法为多。具体原理如下:以待提纯的粗稼(内含Zn、Fe、Cu杂质)为阳极,以高纯稼为阴极,以NaOH水溶液为电解质溶液。 在电流作用下使粗镓在阳极溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①己知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解精炼镓时阳极泥的成分是________________;
② GaO2-在阴极放电的电极方程式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com