
| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{8}$ |
分析 还原性大小为I->Br->Cl-,通入一定量的Cl2使比值变为1:1:1,说明溶液中有剩余的I-,则反应中只氧化I-,溶液中Br-不变,设开始Cl-、Br-、I-三者物质的量分别是2mol、3mol、4mol,计算反应后各离子的物质的量,根据Cl-的物质的量变化计算参加反应的氯气,据此进行解答.
解答 解:还原性:I->Br->Cl-,通入一定量的Cl2,Cl-、Br-、I-三者物质的量之比由2:3:4变为1:1:1,说明溶液还有剩余的I-,则溶液中的Br-不反应,
设开始Cl-、Br-、I-三者物质的量分别是2mol、3mol、4mol,则反应后分别为3mol、3mol、3mol,则Cl-增加3mol-2mol=1mol,
由方程式2I-+Cl2=I2+2Cl-可知参加反应的Cl2为:1mol×$\frac{1}{2}$=0.5mol,
所以通入Cl2的物质的量是原溶液中I-物质的量之比为:$\frac{0.5mol}{4mol}$=$\frac{1}{8}$,
故选D.
点评 本题考查了离子反应的有关计算,题目难度中等,明确发生反应的实质及先后顺序为解答关键,注意熟练掌握卤素单质及其化合物性质,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 取少量浑浊的天然水,加入适量明矾,天然水变得澄清透明 | |
| B. | 分别通过盛有品红溶液的洗气瓶可以鉴别SO2和CO2 | |
| C. | 保存硅酸钠溶液可以使用磨口玻璃塞、细口玻璃瓶 | |
| D. | 向Fe(OH)3胶体中逐滴加入过量的稀盐酸,先生成红褐色沉淀,最后沉淀又溶解 | |
| E. | 用镊子从煤油中夹取小块金属钠直接投入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol青石棉能使1 mol稀硝酸被还原 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉属于新型无机非金属材料 | |
| D. | 青石棉不属于硅酸盐原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| 氨水体积/mL | 40 | V1 | 30 | 20 |
| 盐酸体积/mL | 20 | 60-V1 | 30 | 40 |
| A. | ①所得溶液中,c(NH4+)>c(C1-)>c(NH2•H2O)>c(OH-)>c(H+) | |
| B. | 若②所得溶液pH=7,则c(NH4+)=c(C1-)=1×10-7mo1•L-1 | |
| C. | ③所得溶液中.c(H+)-c(OH-)=c(NH3•H2O) | |
| D. | ④所得溶液中,c(C1-)=2c(NH3•H2O)+2c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3粉末(NaHCO3),加热直至固体质量不再减少 | |
| B. | NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体 | |
| C. | CO2(HCl),将气体依次通过Na2CO3溶液和浓硫酸中 | |
| D. | H2(HCl),将气体通入碱石灰中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
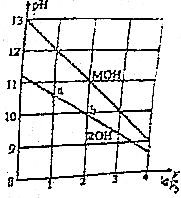 0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )| A. | ROH的电离方程式为ROH═R++OH- | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 等pH的ROH和MOH溶液,则MOH的浓度低 | |
| D. | 当1gV/V0=2时,若两溶液同时升高温度,则C(R+)增大,C(M+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳极的离子 和电极反应式 | 阴极的离子 和电极反应式 | 电解总反应式 | 溶液浓度变化 | 溶液pH的变化 | |
| HCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | 减小 | 增大 |
| CuBr2 | 2Br--2e-=Br2 | Cu2++2e-=Cu | 2Br-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Br2+Cu | 减小 | 增大 |
| KCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | 减小 | 增大 |
| CuSO4 | 4OH--4e-=O2↑+2H2O | Cu2++2e-=Cu | 2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | 减小 | 增大 |
| NaOH | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 增大 |
| H2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 减小 |
| KNO3 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
| Na2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. c(I-)=0.1mol.L-1的溶液中:K+、Na+、SO42-、ClO-
B.使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl-
C.与Al反应能放出大量H2的溶液中:Cl-、Na+、NO3-、Fe2+
D.由水电离出的c(OH-)=1×10--10mol.L-1的溶液中:Ba2+、K+、NO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com