
| A. | V(A)=0.15mol/(l•s) | B. | V(B)=0.6mol/(l•s) | C. | V(C)=0.45mol/(l•s) | D. | V(D)=4.0mol/(l•min) |
分析 不同物质表示的速率之比等于其化学计量数之比,故各物质表示的反应速率与其化学计量数的比值越大,表示的反应速率越快,注意单位保持一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故各物质表示的反应速率与其化学计量数的比值越大,
A.$\frac{v(A)}{1}$=0.15mol/(l•s);
B.$\frac{v(B)}{3}$=0.2mol/(l•s);
C.$\frac{v(C)}{2}$=0.225mol/(l•s);
D.v(D)=4.0mol/(l•min)=0.0667mol/(l•s),$\frac{v(D)}{2}$=0.0334mol/(l•s),
故选:C.
点评 本题考查比较反应速率快慢比较,常用的两种方法:(1)归一法:将同一反应中的不同物质的反应速率转化成同一物质的反应速率,再较小比较.(2)比值法:用各物质的量表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.


科目:高中化学 来源: 题型:解答题
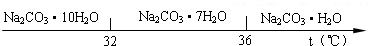
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
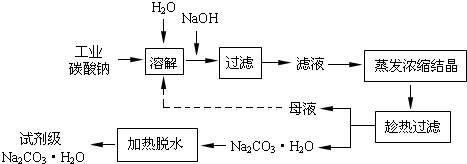
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M2+的离子半径比N3-小 | B. | M的原子序数比N小 | ||
| C. | M与N原子的电子层数相同 | D. | M与N的最外层电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)<KSP(AgBr) | |
| B. | 将0.001mol•L-1 AgNO3溶液滴入0.001mol•L-1 KCl和0.001mol•L-1 K2CrO4混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| D. | 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂为K2S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
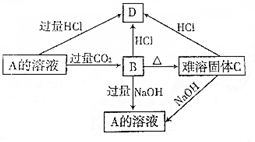
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:填空题
短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E﹣E→2E△H=+a kJ•mol﹣1;
②2A→A﹣A△H=﹣b kJ•mol﹣1;
③E+A→A﹣E△H=﹣c kJ•mol﹣1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g)△H=﹣a kJ•mol﹣1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .
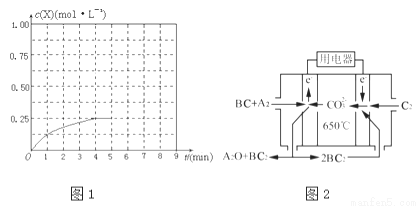
②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
如图所示,下列叙述正确的是

A. Y为阴极,发生还原反应 B. X处有O2生成
C. Y与滤纸接触处有氧气生成 D. X与滤纸接触处变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com