
(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(12分)(1) CuO或Cu(OH)2或 CuCO3或Cu2(OH)2CO3(1分)2.6×10-9 mol·L-1(2分)
(2)2CuCl2·2H2O Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
(3) ①淀粉溶液(1分) 蓝色褪去,放置一定时间后不复色(1分)
②2Cu2++4I-===2CuI↓+I2 (2分) ③95%(2分)
解析试题分析:(1)由于在除杂的过程中不能引入新的杂质,所以要调节溶液的酸碱性,使氢氧化铁析出,而得到纯净的氯化铜晶体,则应该加入氧化铜或氢氧化铜。根据氢氧化铁的溶度积常数可知,当溶液的pH=4时,溶液中铁离子的浓度应该是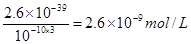 。
。
(2)由于氯化铜在溶液中存在铜离子的水解平衡,而加热促进水解,且生成的氯化氢极易挥发,进一步促进水解,因此得不到氯化铜晶体,反应的化学方程式使是2CuCl2·2H2O Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。
Cu(OH)2·CuCl2+2HCl+2H2O;因此由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水。
(3)①由于碘离子被氧化生成了单质碘,而碘遇淀粉显蓝色,所以选择的指示剂是淀粉溶液。Na2S2O3将单质碘还原生成了碘离子,所以终点时的反应现象是蓝色褪去,放置一定时间后不复色。
②氯化铜能把碘化钾氧化生成单质碘,所以CuCl2溶液与KI反应的离子方程式是2Cu2++4I-===2CuI↓+I2。
③根据有关的反应方程式可知2CuCl2·2H2O~I2~2Na2S2O3,所以氯化铜晶体的物质的量是0.02L×0.1000mol/L=0.002mol,则试样中CuCl2·2H2O的质量百分数为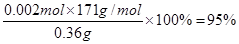 。
。
考点:考查物质的除杂、溶度积常数的有关计算、水解的应用、指示剂的选择以及物质含量的测定和计算
点评:本题是高考中的常见题型,属于难度较大的试题,考查的知识点比较多。这类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。本题有利于培养学生的逻辑推理能力,以及分析问题、解决问题的能力。


科目:高中化学 来源:河南省实验中学2011届高三上学期第一次月考化学试题 题型:038
市场销售的某种食用精制盐包装袋上有如下说明:

(1)碘酸钾与碘化钾在酸性条件下发生如下反应,
KIO3+5KI+3H2SO4![]() 3K2SO4+3I2+3H2O
3K2SO4+3I2+3H2O
上述反应生成的I2可用四氯化碳检验:确认有I2生成的现象是________.
利用Na2SO3稀溶液,将I2还原,可从碘的四氯化碳溶液中回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式为________.
(2)已知:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() 某学生测定食用精制盐的碘含量,其步骤为:
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂.逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全.
①判断c中恰好完全反应依据的现象是________.
②b中反应所产生的I2的物质的量是多少?(写出计算过程)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg).(写出计算过程)
查看答案和解析>>
科目:高中化学 来源:江苏省扬州中学2008-2009学年度第一学期期中考试高二化学(必修)试卷 题型:058
市场销售的某种食用精制盐包装袋上有如下说明:

(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式:
________KIO3+________KI+________H2SO4=________K2SO4+________I2+________H2O
(2)已知:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() .某学生测定食用精制盐的碘含量,其步骤为:
.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是__________.
②b中反应所产生的I2的物质的量是________mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_________mg/kg.(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:058
北京市场销售的某种食用精制盐包装袋上有如下说明:

(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
________KIO3+________KI+________H2SO4=________K2SO4+________I2+________H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是________.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及上述步骤中的位置是________.
(3)已知:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() .某学生测定食用精制盐的碘含量,其步骤为:
.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是________.
②b中反应所产生的I2的物质的量是________mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)________mg/kg.
查看答案和解析>>
科目:高中化学 来源:2014届吉林省长春市高二上学期期末考试化学试卷(解析版) 题型:填空题
(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
|
物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
|
Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用 作滴定指示剂,滴定终点的现象是 。
②CuCl2溶液与KI反应的离子方程式为 。
③该试样中CuCl2·2H2O的质量百分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com