
| 选项 | 化学用语 | 推论 |
| A | ${\;}_{92}^{238}{U}^{3+}$ | 该轴离子核外有89个电子 |
| B | 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ•mol | 1mol氢气完全燃烧放出热量483.6kJ |
| C | 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2+Cl2↑ | NaCl氧化性Cl2强 |
| D | FeO+4H++HNO3-=Fe3++NO2↑+2H2O | 氧化亚铁溶于稀硝酸的离子方程式 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.根据阳离子核外电子等于核内质子数-失去电子数计算;
B.2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol指2mol氢气和1mol氧气完全燃烧生成水时放出的热量为483.6kJ;
C.根据2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2+Cl2↑,在电流的作用下才发生的反应不能据此反应判断氧化性的强弱;
D.稀硝酸的还原产物一般为NO,据此判断.
解答 解:A.因为阳离子核外电子等于核内质子数-失去电子数,所以该轴离子核外有92-3=89个电子,故A正确;
B.根据热化学方程式的意义,2H2(g)+O2(g)=2H2O(g)△H=-483.6kj•mol指2mol氢气和1mol氧气完全燃烧生成水时放出的热量为483.6kJ,故B错误;
C.2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2+Cl2↑,在电流的作用下才发生的反应不能据此反应判断氧化性的强弱,应根据氯元素的化合价判断,Cl2氧化性比NaCl强,故C错误;
D.稀硝酸的还原产物一般为NO,所以氧化亚铁溶于稀硝酸生成三价铁和NO,故D错误;
故选A.
点评 本题考查了核外电子的计算、热化学方程式的意义、氧化性的比较以及离子方程式的判断,题目难度不大,掌握基础是解题关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
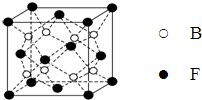 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)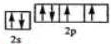 ;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族
;H离子电子排布式1s22s22p63s23p6;I位于周期表ds区;D在周期表中的位置第二周期ⅤⅡA族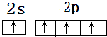 ,不符合能量最低原理原理.
,不符合能量最低原理原理.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期ⅠB族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
 ,研究表明•
,研究表明• ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓.
,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓. (或
(或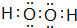 ),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 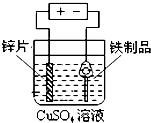 铁制品表面镀锌 | B. | 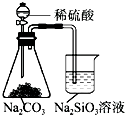 验证碳酸酸性强于硅酸 | ||
| C. | 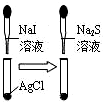 说明溶解性AgCl<AgI<Ag2S | D. | 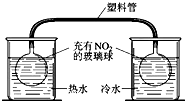 浸在冷水中的玻璃球颜色较深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钫与水反应发生爆炸,生成的氢氧化物FrOH是一种极强的碱 | |
| B. | 钫极易在氧气中燃烧,燃烧生成复杂的氧化物 | |
| C. | 砹单质是有色气体,易溶于CCl4等有机溶剂 | |
| D. | 砹单质不容易与氢气化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com