
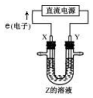
| A. | 若 Z 为饱和食盐水,则 X 是阴极 | |
| B. | 若 Z 为饱和食盐水,则碱在 X 附近生成 | |
| C. | 若 Z 为氯化铜溶液,Y 附近能得到氯气 | |
| D. | 若 Z 为氯化铜溶液,X 附近发生氧化反应 |
分析 根据电子流向知,X为阳极、Y为阴极,若Z为饱和食盐水,X电极上氯离子放电生成氯气,Y电极上水得电子生成氢气和OH-;
若Z为氯化铜溶液,X电极上氯离子放电生成氯气,Y电极上铜离子得电子生成Cu.
解答 解:根据电子流向知,X为阳极、Y为阴极,若Z为饱和食盐水,X电极上氯离子放电生成氯气,Y电极上水得电子生成氢气和OH-;
若Z为氯化铜溶液,X电极上氯离子放电生成氯气,Y电极上铜离子得电子生成Cu;
A.通过以上分析知,若 Z 为饱和食盐水,则 X 是阳极,故A错误;
B.若 Z 为饱和食盐水,X电极上氯离子放电生成氯气,Y电极上水得电子生成氢气和氢氧根离子,则碱在Y 附近生成,故B错误;
C.若 Z 为氯化铜溶液,X电极上生成氯气、Y电极上生成Cu,故C错误;
D.若 Z 为氯化铜溶液,X电极上氯离子失电子发生氧化反应生成氯气,所以X 附近发生氧化反应,故D正确;
故选D.
点评 本题考查电解原理,为高频考点,正确判断阴阳极及明确离子放电顺序是解本题关键,知道各个电极上发生的反应,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
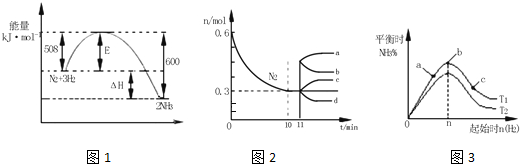
 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,其 中q为淡黄色固体;x、y、z是这些元素组成的二元化合物;25℃,0.01mol•L-1w溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是 ( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q,其 中q为淡黄色固体;x、y、z是这些元素组成的二元化合物;25℃,0.01mol•L-1w溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是 ( )| A. | 离子半径的大小:a<b<c<d | |
| B. | b氢化物的沸点高于主族其它元素氢化物的沸点 | |
| C. | 将b、c、d组成的化合物加入到水中对水的电离没有影响 | |
| D. | y、w含有的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量氨水:NH4+、Cl-、[Cu(NH3)4]2+ | |
| B. | 通入过量Cl2:Fe2+、Cu2+、C-、H+ | |
| C. | 加入过量铁粉:Cu2+、Fe2+、Cl-、H+ | |
| D. | 加入过量KSCN溶液:Na+、K+、Fe3+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )
X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )| A. | X 元素位于ⅥA | B. | A 不能溶解于 B 中 | ||
| C. | B 的沸点高于 C 的沸点 | D. | A 和 C 不可能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO4 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的葡萄糖 |
| ④ | 将装满氯水的圆底烧瓶倒置在有氯水的水槽中,日光照射 | -- | 烧瓶内有气泡产生,说明日光照射导致溶解的Cl2逸出 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:填空题
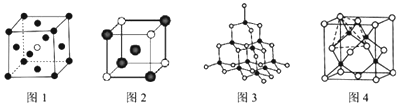
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,Z原子的配位数是 。

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、M的原子半径依次减小 | |
| B. | Y与M组成化合物的熔点高于X与M组成的化合物 | |
| C. | X、Z、M的最低价气态氢化物的热稳定性依次增强 | |
| D. | X的单质与Y、Z的最高价氧化物均能发生置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com