
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m﹣3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
(1)已知:
C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ•mol﹣1 ①
2H2(g)+O2(g)=2H2O(g)△H2=﹣483.6kJ•mol﹣1 ②
C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3kJ•mol﹣1 ③
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H= kJ•mol﹣1.标准状况下的煤炭气(CO、H2)33.6L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e﹣.
(2)密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g);CO的平衡转化率(a)与温度、压强的关系如图所示.
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= .
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”).
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 .
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来.

考点:
用盖斯定律进行有关反应热的计算;化学平衡的影响因素;转化率随温度、压强的变化曲线.
专题:
化学反应中的能量变化;化学平衡专题.
分析:
(1)依据热化学方程式和盖斯定律来计算得到;依据n= 计算物质的量结合化学方程式的电子转移计算;
计算物质的量结合化学方程式的电子转移计算;
(2)①A、B点是同温度下的平衡,转化率变化,但平衡常数不变,结合化学平衡三段式列式计算A处的平衡常数,A点一氧化碳转化率为50%,B点一氧化碳转化率为70%;
②C点温度高速率达,达到平衡所需要的时间短;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.
解答:
解:(1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol①
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol②
由盖斯定律①﹣②得到CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=﹣524.8KJ/mol;
在标准状况下,33.6L的煤炭合成气物质的量为1.5mol,与氧气完全反应生成CO2和H2O,反应过程中2mol合成气完全反应电子转移4mol,所以1.5mol合成气反应转移电子3mol;
故答案为:﹣524.8; 3;
(3)CO(g)+2H2(g)⇌CH3OH(g),图象分析温度越高,一氧化碳转化率减小,逆向进行,正反应是放热反应;
①依据图象分析可知AB是同温度下的平衡,平衡常数随温度变化,所以平衡常数不变,A点一氧化碳转化率为50%,B点一氧化碳转化率为70%,密闭容器中充有10mol CO与20mol H2,A点平衡常数结合平衡三段式列式计算;
CO(g)+2H2 (g)⇌CH3OH(g)
起始量(mol) 10 20 0
变化量(mol) 5 10 5
平衡量(mol) 5 10 5
平衡常数K= =
=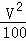 L2/mol2;
L2/mol2;
B点一氧化碳转化率为70%,
则 CO(g)+2H2 (g)⇌CH3OH(g)
起始量(mol) 10 20 0
变化量(mol) 7 14 7
平衡量(mol) 3 6 7
A、B两点时容器中,n(A)总:n(B)总=(5+10+5):(3+6+7)=20:16=5:4;
故答案为: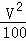 L2/mol2;5:4;
L2/mol2;5:4;
②达到A、C两点的平衡状态所需的时间,C点温度高反应速率快达到反应速率需要的时间短,tA>tC,故答案为:大于;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,故答案为:ABD.
点评:
本题考查了热化学方程式和盖斯定律的计算应用,化学平衡标志判断,图象分析,影响平衡的因素分析判断,化学平衡移动原理是解题关键,题目难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:填空题
【化学选修3-物质结构与性质】(15分)a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基基态原子的P轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种_________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm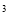 ,则晶胞的体积为________(
,则晶胞的体积为________(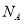 用表示阿伏加德罗常数的值)。
用表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在4℃时下列溶液一定呈酸性的是( )
|
| A. | pH=7的溶液 |
|
| B. | 遇酚酞显无色的溶液 |
|
| C. | 含有H+的溶液 |
|
| D. | 溶液中由水电离出的C(OH﹣)=10﹣9 mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,把3mol A和2.5mol B混合,盛入容积为2L的容器内,使它们发生反应:3A(气)+B(气)⇌xC(气)+2D(气),经过5min后达到平衡生成1mol D,测得C的平均生成速率为0.10mol•L﹣1•min﹣1.下列叙述不正确的是( )
|
| A. | x的值为2 |
|
| B. | B的转化率为20% |
|
| C. | 平衡常数为 |
|
| D. | A的平均消耗速率为0.15mol•L﹣1•min﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1.01×105 Pa、298K条件下,2mol H2燃烧生成水蒸气时放出484kJ热量.下列热化学方程式中正确的是()
A. H2O(g)═H2(g)+ O2(g)△H=+242 kJ•mol﹣1
O2(g)△H=+242 kJ•mol﹣1
B. 2H2(g)+O2(g)=2H2O(l)△H=﹣484 kJ•mol﹣1
C. H2O(g)+ O2(g)=H2O(g)△H=+242 kJ•mol﹣1
O2(g)=H2O(g)△H=+242 kJ•mol﹣1
D. 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3+5O2⇌4NO+6H2O在一定体积的密闭容器中进行,30s后NO的物质的量浓度增加了3mol/L,则下列反应速率正确的是()
A. v(NO)=0.1 mol•(L•s)﹣1 B. v(NO)=0.02 mol•(L•s)﹣1
C. v(NH3)=0.01 mol•(L•s)﹣1 D. v(NH3)=0.2 mol•(L•s)﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下列实验操作和相应的离子方程式的说法正确的是()
A. 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH﹣+H+=Mg(OH)2↓+H2O
B. Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3﹣+OH﹣=CaCO3↓+2H2O
C. 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4﹣+6H++5H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com