
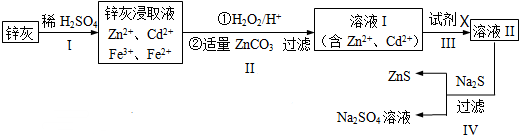
分析 锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的溶液Ⅰ和滤渣Fe(OH)3、ZnCO3;步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌.
(1)根据有效化学反应速率的因素分析,如搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率;
(2)用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,根据上面的分析判断步骤Ⅱ所得滤渣的组成;
(3)向含有镉离子、锌离子的溶液Ⅰ中加入锌,即可置换出Cd单质,又不引入新的杂质;
(4)①检验ZnS固体是否洗涤干净也就是检验最后一次洗涤液中是否含有硫酸根;
②等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒写出该化学反应方程式;
(5)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为:VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,根据锌元素守恒可知,样品中锌元素的物质的量,然后根据m=nM计算出锌灰中含有锌元素的质量.
解答 解:锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的溶液Ⅰ和滤渣Fe(OH)3、ZnCO3;步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌.
(1)搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率,加压对锌灰的浸取率无影响,
故答案为:④;
(2)根据上面的分析可知,用碳酸锌调节平衡pH使Fe(OH)3完全沉淀,反应的离子方程式为ZnCO3+2H+=Zn2++CO2↑+H2O、Fe3++3H2O=Fe(OH)3↓+3H+,所以步骤Ⅱ所得滤渣为Fe(OH)3、ZnCO3,
故答案为:调节溶液的pH,使Fe3+水解Fe(OH)3而除去;Fe(OH)3、ZnCO3;
(3)向含有镉离子、锌离子的溶液Ⅰ中加入锌,即可置换出Cd单质,又不引入新的杂质,
故答案为:Zn;
(4)①检验ZnS固体是否洗涤干净也就是检验最后一次洗涤液中是否含有硫酸根,具体操作为:取最后的洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净,
故答案为:取最后的洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净;
②等物质的量的Na2S04和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为:Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2,
故答案为:Na2S04+CH4$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$Na2S+2H2O+CO2;
(5)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为:VL×c mol/L=cVmol,所以硫酸锌的物质的量为cVmol,
根据锌元素守恒可知,样品中锌元素的物质的量为:cVmol-d mol-b mol,
所以锌灰中含有锌元素的质量为:65g/mol×(cVmol-d mol-b mol)=65(Vc-b-d)g,
故答案为:65(Vc-b-d)g.
点评 本题为工艺流程题,通过从废渣中制取硫化锌的工艺流程,考查了溶解平衡的移动、氧化还原方程式的书写、物质的分离等知识,熟悉物质的性质、明确流程是解题关键,试题侧重学生分析问题、解决问题能力的培养,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3溶液中,$\frac{1}{2}$c(K+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 某浓度的NaAc溶液的pH=8,则该溶液中的c(Na+)-c(Ac-)=9.9×10-7mol/L | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4两种溶液,c(NH4+)大小顺序为:①>② | |
| D. | 10mLpH=12的烧碱溶液中加入pH=2的酸HA至中性,所需酸溶液的体积V≥10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | Zn 具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 由2 mol H原子形成1 mol H-H键要吸收热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 | |
| B. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| C. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| D. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
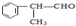 的物质,该物质是一种香料.
的物质,该物质是一种香料.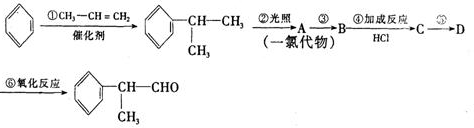
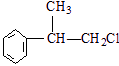 、
、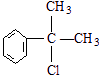 .
.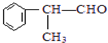 的官能团的名称醛基.
的官能团的名称醛基.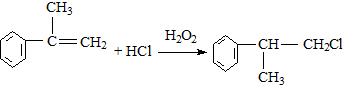 .
.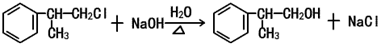 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成(如图),有关如图两种化合物的说法正确的是( )| A. | 常温下,1mol丁香酚只能与1mol Br2发生反应 | |
| B. | 香兰素分子中至少有12个原子共平面 | |
| C. | 1mol香兰素最多能与3mol氢气发生加成反应 | |
| D. | 丁香酚不能与FeCl3溶液发生显色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com