
分析 (1)同一周期元素的电负性随着原子序数的增大而呈增大的趋势;
(2)根据价层电子对互斥理论确定氨气分子空间结构,价层电子对个数为4且含有一个孤电子对时,其空间构型为三角锥形结构;原子个数相等、价电子数相等的微粒互为等电子体;
(3)①镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式;
②离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
③因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6;
(4)铜是29号元素,在元素周期表位置:第四周期、ⅠB族,价电子排布式为3d104s1,Au原子的价电子排布式为5d106s1;
根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;
铜金合金晶体属于金属晶体,据此判断化学键类型;
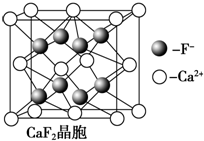
CaF2的结构如图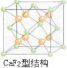 ,利用均摊法计算.
,利用均摊法计算.
解答 解:(1)同一周期元素的电负性随着原子序数的增大而呈增大的趋势,
故答案为:O>N>C;
(2)氨气分子中价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4且含有一个孤电子对,所以氨气分子为三角锥形结构;N2H4分子中原子个数为6、价电子数为14,与其属于等电子体的有CH3OH(CH3SH),
故答案为:三角锥形;CH3OH(CH3SH);
(3)①镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式,Ni的核外电子排布式是1s22s22p63s23p63d 84s2,
故答案为:1s22s22p63s23p63d 84s2;
②Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO;
故答案为:>;
③因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6.
故答案为:6;6;
(4)铜是29号元素,在元素周期表位置:第四周期、ⅠB族,价电子排布式为3d104s1,元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为5d106s1;
铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×$\frac{1}{2}$=3,晶胞中Au原子数目=8×$\frac{1}{8}$=1,故晶胞中Cu原子与Au原子数量之比为3:1;铜金合金晶体属于金属晶体,含有化学键类型为金属键;
CaF2的结构如图 ,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,则H原子应位于晶胞内部,则应含有8个H,则化学式为Cu3AuH8,
故答案为:5d106s1;3:1;金属键;Cu3AuH8.
点评 本题考查了分子空间构型的判断、等电子体理论及元素的核外电子排布式、化学键类型、均摊法计算原子个数比及化学式等知识,题目难度中等,注意均摊法的应用和知识的迁移能力的培养.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 将2mol SO3气体通入一定密闭容器中,反应达到平衡后吸收Q kJ热量,则该反应的热化学方程式为 2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ•mol-1 | |
| B. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向1mL 0.1mol/LAgNO3溶液中滴加2滴0.1mol/LNaCl溶液,振荡后,再滴加2滴0.1mol/LKI溶液 | 先产生白色沉淀,后产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 加热盛有浓硫酸和可抽动铜丝的试管,并将产生的气体通入到品红溶液中 | 品红溶液褪色,且试管中只产生蓝色溶液 | 浓硫酸具有强氧化性 |
| C | 向丙烯醇(HOCH2CH=CH2)中滴入少量酸性高锰酸钾溶液 | 溶液紫红色褪去 | 丙烯醇中含有碳碳双键 |
| D | 碳酸钠溶液中滴加稀硫酸后,将产生的气体通入到硅酸钠溶液中 | 产生白色沉淀 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石可用于炼铁、制水泥、制玻璃 | |
| B. | 使用苯代替酒精擦拭手机屏幕 | |
| C. | 同位素示踪法、红外光谱法都是科学家经常使用的研究化学反应历程的手段之一 | |
| D. | 针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学的核心 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示二氧化碳分子 可以表示二氧化碳分子 | |
| B. | S2-的结构示意图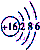 | |
| C. | 电子式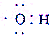 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 光气((COCl2)结构式: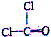 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向20mL1mol/L的FeBr2溶液中通入0.02molCl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向漂白粉溶液中通入少量的SO2:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO | |
| D. | 单质钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 原子半径:X>Y>Z | D. | 原子最外层电子数:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与CO2 | B. | Na与O2 | C. | NaOH与CO2 | D. | NaAlO2与HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com