
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ba2+、SO32-、ClO- | ||
| C. | Fe2+、K+、SO42-、NO3- | D. | Na+、Fe3+、S2-、Cl- |
分析 A.四种离子之间不反应,都不与酸性溶液中的氢离子反应;
B.次氯酸根离子能够氧化亚硫酸根离子,次氯酸根离子、亚硫酸根离子都能够与氢离子反应;
C.酸性条件下硝酸根离子能够氧化亚铁离子;
D.铁离子能够氧化硫离子,硫离子能够与酸性溶液中的氢离子反应.
解答 解:A.Ca2+、K+、Cl-、NO3-之间不发生反应,都不与酸性溶液中的氢离子反应,在溶液中能够大量共存,故A正确;
B.SO32-、ClO-之间发生氧化还原反应,且二者都与氢离子反应,在溶液中不能大量共存,故B错误;
C.Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Fe3+、S2-之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
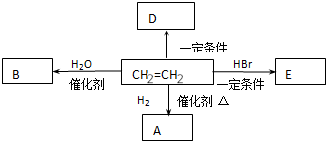
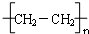 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲醇 | -97.8℃ | 64.8℃ | 0.791g•mL-1 | 易溶于水、乙醇、正丙醇 |
| 正丙醇 | -126.5℃ | 97.4℃ | 0.804g•mL-1 | 能跟水、甲醇、乙醇以任意比互溶 |
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
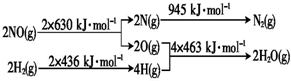
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中可以含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物可能是共价化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与SO42-浓度有关 | |
| B. | 催化剂能加快化学反应速率,但反应物所需活化能不变 | |
| C. | 碘单质是过氧化氢分解的催化剂 | |
| D. | 与一定量H2O2反应的KI溶液浓度越大,反应速率越慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com