
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,下列叙述正确的是
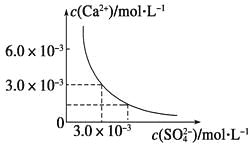
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
【答案】D
【解析】
由图知,Ksp(CaSO4)=c(Ca2+)·c(SO42-)=3.0×10-3×3.0×10-3=9×10-6,在CaSO4饱和溶液中c(Ca2+)=c(SO42-)=3.0×10-3 mol·L-1。加入400 mL 0.01 mol·L-1 Na2SO4溶液后,c(Ca2+)=6×10-4(mol·L-1),=8.6×10-3(mol·L-1),Qc=c(Ca2+)·c(SO42-)=6×10-4×8.6×10-3=5.16×10-6<Ksp,所以没有(CaSO4沉淀析出,但溶液中c(SO42-)变大了,c(Ca2+)变小了,故只有D项正确,
答案选D。


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
请根据要求填写下列空白:
(1)溶液①呈_____性(填“酸”、“碱”或“中”),其原因是________(用离子方程式表示)。
(2)比较②③溶液中,c(NH4+)的大小关系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 离子的浓度为0.1mol/L;NH3H2O和_____离子的物质的量浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
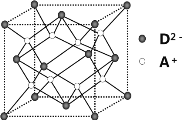
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为__________,在CB3分子中C元素原子的原子轨道发生的是__________杂化。
(2)C的氢化物的空间构型为__________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________。
(3)B元素的电负性__________D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:__________。
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为__________。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为
A. 32 g B. 48 g C. 64 g D. 96 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A物质是由茶叶中一种有机物衍变而来。已知:
①A物质氢原子核磁共振谱有6种。
②H结构简式为:
它们的关系如下:

请回答下列问题:
(1)有机物X的结构简式为_______
(2)指出反应①、②、③的反应类型:①______② ______③______。
(3)写出下列反应的化学方程式(有机物写结构简式)
①D—E:_____________
②F在浓硫酸加热条件下发生缩聚反应的化学方程式:____________
(4)写出所有符合下列条件的A的同分异构体的结构简式:__________
①苯环上只有一个取代基
②能发生水解反应
③能与银氨溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)HCl、NH4Cl、CH3COOH和CH3COONa是中学常见的物质。
①常温下在pH=7的CH3COOH和CH3COONa的混合液中c(Na+)_______c(CH3COO-)(填“>”、“<”或“=”);
②常温下pH均为6的HCl和NH4Cl两种溶液中,设由水电离产生的H+浓度分别为amol/L和bmol/L,则a与b的关系是_______;
A.a=b B.a=100b C.b=100a
(2)T℃,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C物质的量变化如图所示。

①T℃时,该反应的化学方程式为________;
②0~4分钟时,A的平均反应速率为_______molL-1min-1;
③达到平衡时B的转化率为________;
④T℃时,该反应的平衡常数为________。
(3)将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)ΔH=+140.5kJ/mol
C(s,石墨)+![]() O2(g)=CO(g) ΔH=-110.5kJ/mol
O2(g)=CO(g) ΔH=-110.5kJ/mol
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)的ΔH是_______。
A.+80.5kJ/mol B.+30.0kJ/mol
C.-30.0kJ/mol D.-80.5kJ/mol
(4)Cu(OH)2在水溶液中存在溶解平衡:Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)c2(OH-)=2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,则产生沉淀,反之无沉淀。某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH>________。
Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)c2(OH-)=2×10-20。当溶液中各离子浓度幂的乘积大于溶度积时,则产生沉淀,反之无沉淀。某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH>________。
(5)茫茫黑夜中,航标灯为航海员指明了方向.航标灯的电源必须长效、稳定。我国科技工作者研制出以铝合金、Pt-Fe合金网为电极材料的海水电池。
①该电池中,海水是电解质溶液,负极材料_______(填“铝合金”或“Pt-Fe合金网”);
②该电池中负极电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述中正确的是

A. 用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液
B. 装置②的总反应式:Cu + 2Fe3+ = Cu2+ + 2Fe2+
C. 装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
D. 装置④中插入海水中的铁棒,越靠近底端腐蚀越严重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是________________(填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_____________________(用离子方程式表示)
(2)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为____________________________
(3)25℃时,几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_____先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为____(KspCu(OH)2=1×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )。
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH一定等于7
B.0.1molAgCl和0.1AgBr混合后加入水中,所得溶液![]()
C.向0.1mol/LNa2SO3溶液中通SO2气体至溶液pH=7:![]()
D.0.1mol/LNH4Cl溶液与0.1mol/L氨水等体积混合pH>7:c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com