
����Ŀ����2�֣�һ���¶��£����淴Ӧ2NO2![]() 2NO+O2��������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ� ��
2NO+O2��������̶����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ� ��
����λʱ��������n mol O2��ͬʱ����2n mol NO2��
����λʱ��������n mol O2��ͬʱ����2n mol NO��
��NO2��NO��O2��Ũ�ȱ�Ϊ2��2��1��
����������ѹǿ���ٸı䣻
������������ɫ���ٸı䣻
����������ƽ��Ħ���������ٸı䣮
A. �٢ܢݢ� B. �٢ڢۢ� C. �ڢۢܢ� D. ����ȫ��
���𰸡�A
����������һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ(����Ϊ0)����Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬����ٵ�λʱ��������nmolO2������Ӧ��ͬʱ����2nmolNO2���淴Ӧ���һ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ����淴Ӧ������ȣ��ʢ���ȷ���ڵ�λʱ��������nmolO2������Ӧ��ͬʱ����2nmolNOҲ������Ӧ���ʢڴ�������ʱ������ѧ��Ӧ����֮�ȶ����ڻ�ѧ������֮�ȣ�����NO2��NO��O2��ʾ�ķ�Ӧ���ʵı�Ϊ2:2:1��״̬.������Ϊ�ж��Ƿ�ﵽƽ��״̬�����ݣ��۴�������Ӧǰ������������ͬ���ʻ�������ѹǿ���ٸı��״̬����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ�������ȷ����NO2Ϊ����ɫ���壬O2��NOΪ��ɫ���壬�ʻ���������ɫ���ٸı䣬˵��NO2Ũ�Ȳ��䣬����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ�������ȷ����ƽ����������������������������ʵ����ı�ֵ�����������䣬�����ʵ����ڱ䣬�ʻ�������ƽ����Է����������ٸı��״̬����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ�����ȷ����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������298 K��100 kPaʱ����1 Lˮ�п��ܽ�0.090 mol��ʵ��������ˮ��Cl2Լ������֮һ��ˮ��Ӧ����ش��������⣺
��1���÷�Ӧ�����ӷ���ʽΪ______________________________________��
��2��������ƽ����ϵ�м�������NaCl���壬ƽ�⽫��________�ƶ�(��������Ӧ�����������淴Ӧ��������������)��
��3���������������ѹǿ��������ˮ�е��ܽ�Ƚ�________(����������������С������������)��ƽ�⽫��________�ƶ���(��������Ӧ�����������淴Ӧ��������������)
��4���ڱ�����ˮ�м���ʯ��ʯ�ɵõ��ϴ�Ũ�ȵĴ�������Һ��������ѧ���Ļ�ѧԭ�����н��ͣ����ԣ�����>̼��>�����ᣩ��_______________________��д����ˮ��ʯ��ʯ��Ӧ�����ӷ���ʽ��______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʵ���е���Ϊ�����ϰ�ȫҪ�����
A������ú������ҵ�����ϰ�ȫñ����ñ�ϵĿ������
B�������ڼ䣬���������ַ������̳���ȼ���̻����������
C����ȼ���������Լ���Һ������ƿ���Ƿ�©��
D��ʵ��������Խ�ˮ����Ũ�����м�ʱ�ò��������裬����ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.��Ȼ������Ҫ�ɷּ����Ǹ�Ч���Ͻྻ��ȼ��
B.ʯ�͵ķ���ú��������Һ�����������仯
C.ʯ�͵��ѻ���Ҫ��Ϊ�˵õ������������
D.�����������̲��ŷḻ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.���뱽������ɫ����Һ��K+��NH4+��Cl����I���������̪�ʺ�ɫ����Һ��SO42����K+��Cl����HSO3���ֱ��ܴ������棨�����£�
B.![]() =1��10��12����Һ��K+��AlO2����CO32����Na+�� pH=2����Һ��NO3����Fe2+��Na+��Al3+�ֱ��Դ������棨�����£�
=1��10��12����Һ��K+��AlO2����CO32����Na+�� pH=2����Һ��NO3����Fe2+��Na+��Al3+�ֱ��Դ������棨�����£�
C.��֪��25��ʱ��Mg��OH��2��Ksp=5.61��10��12 �� MgF2��KSP=7.42��10��11 �� 25��ʱ����Mg��OH��2������Һ�м���NaF��Һ��Mg��OH��2 ����ת��ΪMgF2
D.��ʾH2ȼ���ȵĻ�ѧ����ʽΪ��H2��g��+ ![]() O2��g���TH2O��1������H=��285.8kJ/mol
O2��g���TH2O��1������H=��285.8kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧʵ�鰲ȫ����������в���ȷ����
A��������Ũ����մ��Ƥ����ʱ������ֱ���ô�����ˮ��ϴ
B��ȡ�û�ѧҩƷʱ��Ӧ�ر�ע��۲�ҩƷ��װ�ϵİ�ȫ��ʾ���
C�����Ǹ�������������ʱ����Ҫ�ӵ�ʯ�������Է�����ը��
D�����κλ�ѧҩƷ����ζ������ʹ���Ӵս�ҩƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ����������Ӧ�ù㷺�������������⣮
��1������ͭ��Һʱ���������ж���һ�ֽⶾ����
P4+CuSO4+H2O��Cu3P+H3PO4+H2SO4 �� ��6molH3PO4���ɣ���CuSO4������P4�����ʵ���Ϊ ��
��2�����Ļ�����ϳɡ�Ӧ�ü����Ĺ̶�һֱ�ǿ�ѧ�о����ȵ㣮��CO2��NH3Ϊԭ�Ϻϳɻ������ص���Ҫ��Ӧ���£�
��2NH3��g��+CO2��g��=NH2CO2NH4��s������H=��159.47kJmol��1
��NH2CO2NH4��s��=CO ��NH2��2��s��+H2O��g������H=a kJmol��1
��2NH3��g��+CO2��g��=CO��NH2��2��s��+H2O��g������H=��86.98kJmol��1
��aΪ ��
��3����ͼ��ʾʹ�����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl��NH4ClΪ�������Һ����������ṩ������ͬʱ����ʵ�ֵ��̶�������ȼ�ϵ�أ���д���õ�ص�������Ӧʽ �� �����пɷ����������A�Ļ�ѧʽΪ �� 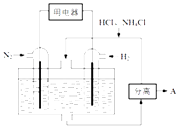
��4�������£���0.1mol/L��ˮ�м�������N2O5 �� ʹ��Һ��c��NH3H2O����c��NH4+��=5��9����ʱ��Һ��pH= �� ��25��ʱ��NH3H2O�ĵ��볣��Kb=1.8��10��5��
��5��SiO2��������������һ�ּ�ǿ�Ķ�Ԫ���ˮ��������������3��Ԫ����ɣ����з��������������Ϊ79.17%����д��SiO2�������������ӷ���ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 mol SO2��2 mol SO3��������ij�̶�������ܱ������У���һ�������·�Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)��ƽ��ʱSO3ΪW mol����ͬ�¶��£��ֱ������������ͬ����������з�Ӧ����Ӧ�ﵽƽ��ʱ��SO3�����ʵ�������W mol����(����)
2SO3(g)��ƽ��ʱSO3ΪW mol����ͬ�¶��£��ֱ������������ͬ����������з�Ӧ����Ӧ�ﵽƽ��ʱ��SO3�����ʵ�������W mol����(����)
A��2 mol SO2��1 mol O2B��4 mol SO2��1 mol O2
C��2 mol SO2��1 mol O2��2 mol SO3D��3 mol SO2��1 mol SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/L��NH3��H2O��Һ�д������µ���ƽ�⣺NH3��H2O![]() NH4++OH-���ڸ�ƽ�⣬����������ȷ����
NH4++OH-���ڸ�ƽ�⣬����������ȷ����
A. ��������NaOH���壬��Һ��c(OH-)����
B. ͨ������HCl���壬ƽ��������Ӧ�����ƶ�
C. ��������ˮ��ƽ�����淴Ӧ�����ƶ�
D. ��������NH4Cl���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com