
����Ŀ�������£���20mLij������Һ����μ���0.1mol/L�İ�ˮ����ҺpH�ı仯����백ˮ�������ϵ��ͼ��ʾ������������ȷ����

A. ��������ʵ���Ũ��Ϊ1mol/L
B. ��������֮�������һ�㣺c��Cl������c��NH4+����c��H+����c��OH����
C. �ڵ�����ʾ��Һ�У���ˮ�������c��OH������10��7mol/L
D. �ڵ�����ʾ��Һ�У�c��NH4+��=c��Cl������c��OH����=c��H+������V ��20
���𰸡�B
�����������������A����δ�Ӱ�ˮʱ�������PH=1��HCl��ǿ�������ȫ���룬�����ӵ�Ũ��=HCl��Ũ�ȣ�������������ʵ���Ũ��=0.1mol/L����A����B�����ü�ֵ����������δ�Ӱ�ˮʱ����Һ��û��笠����ӣ�����c��Cl-����c��NH4+��������Һ�����ԣ��������ӵ�Ũ�ȴ������������ӵ�Ũ��c��H+����c��OH-������B��ȷ��C����������Һ���Ǽ���Һ������ˮ�ĵ��룬������ʾ��Һ�ʼ��ԣ�������ˮ�ĵ��룬������ˮ�������c��OH-����10-7mol/L����C����D������Һ��PH=7ʱ����Һ��c��H+��=c��OH-������Һ�ʵ����ԣ�����c��Cl-��=c��NH4+�����Ȼ����ǿ����������Һ�����ԣ�Ҫʹ��Һ�ʼ��ԣ���ˮ�����ʵ���Ӧ������һЩ����V��20����D����ѡB��


 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������Ҫ�ɷ�ΪAl2O3������Fe2O3��SiO2�����ʣ���ȡ��ˮ�Ȼ�����һ�ֹ�������ʾ�����£�
��֪��

���� | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
�е�/�� | 57.6 | 180�������� | 300�������� | 1023 |
��1���������б���ʹ����ˮ�ֻӷ���������Ŀ���࣬��������_________________��ֻҪ��д��һ�֣���
��2��������������ͨ����������������Ӧ�������ԭ�������ȹ��ĵ�����________________��
��3��������̼�������ݷ���������V�м������۵�Ŀ����________________��
��4����ȡ��Fe2O3��Al2O3������0.2000g�������ܽ���pH=2.0������Һ�У�50�����ң����Իǻ�ˮ����Ϊָʾ������0.02000 mol/L EDTA����Һ�ζ������е�Fe3+����ȥ18.00 mL��Ȼ����Һ����pH=3.5����������EDTA����Һ25.00 mL����������У�ʹAl3+��EDTA��ȫ��Ӧ���ٵ���ҺpH=4.5����PAN��1-��2-���ż����-2-���ӣ�Ϊָʾ����������CuSO4����Һ��ÿ������CuSO4��5H2O 0.005000g�����ζ�����ȥ8.00 mL������������Fe2O3��Al2O3������������________________��д��������̣�
����֪��EDTA��Fe3+��Al3+��Cu2+�������ʵ���֮��1��1���з�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ᴿ����������������Ϊ��������ѡ�õ��Լ��ͷ��뷽������ȷ����
���� | �Լ� | ���뷽�� | |
A | ������Һ��NaCl�� | ˮ | ���� |
B | CaCO3��CaO�� | ˮ | ���� |
C | KCl��Һ��I2�� | �ƾ� | ��ȡ |
D | CO2��HCl�� | ����̼��������Һ | ϴ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��19������Ҷ���Ž��з��ͻ�������ǣ� ��
A.���ԭ��ѧ˵
B.����Ԫ��������
C.�������ѧ˵
D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.78molFeCl2��Һ��ͨ��0.09molCl2�� �ټ���100mL1mol/L��X2O72-������Һ��ʹ��Һ�е�Fe2+ǡ��ȫ���������������X�Ļ��ϼ�Ϊ ( )
A��+3 B��+2 C��+1 D��+5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���һ���ͷų��������ǣ� ��
A.���Ϸ�Ӧ
B.�ֽⷴӦ
C.���Ӳ��ԭ��
D.ԭ����ɷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2��g��+3H2��g��![]() 2NH3��g�� ��H=-92.4KJ/mol����500�桢20MPaʱ����N2��H2ͨ�뵽���Ϊ2L���ܱ������У���Ӧ�����и������ʵ����ʵ����仯��ͼ��ʾ��
2NH3��g�� ��H=-92.4KJ/mol����500�桢20MPaʱ����N2��H2ͨ�뵽���Ϊ2L���ܱ������У���Ӧ�����и������ʵ����ʵ����仯��ͼ��ʾ��
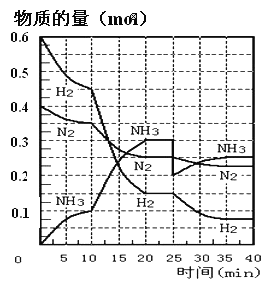
��1��10min����NH3��ʾ�÷�Ӧ��ƽ�����ʣ�v��NH3��= _______��
��2����10-20min��NH3Ũ�ȱ仯��ԭ�������_______������ĸ����
a.���˴��� b.�����¶� c.����NH3�����ʵ���
��3���ÿ��淴Ӧ�ﵽƽ��ı�־��___������ĸ��
a.3v��H2����=2v��NH3����
b.���������ܶȲ�����ʱ��仯
c.�����ڵ���ѹǿ������ʱ����仯
d.N2��H2��NH3�ķ�����֮��Ϊ1:3:2
e.��λʱ������mmolN2��ͬʱ����3mmolH2
f.amolN=N�����ѵ�ͬʱ����6amolN-M���ϳ�
��4����һ��ƽ��ʱ��ƽ�ⳣ��K1=____������ѧ����ʽ��ʾ����NH3�����������_____������2λС������
��5���ڷ�Ӧ���е�25minʱ�����߷����仯��ԭ����______��
��6����֪��N2��g��+3H2![]() 2NH3��g�� ��H=-92.4KJ/mol
2NH3��g�� ��H=-92.4KJ/mol
2H2��g��+O2��g��![]() 2H2O��g�� ��H=-483.6KJ/mol
2H2O��g�� ��H=-483.6KJ/mol
������ȫȼ��������̬ˮ���Ȼ�ѧ����ʽ��______
��7������ȼ�ϵ�ؾ��кܴ�ķ�չDZ��������ȼ�ϵ�ع���ԭ����ͼ��ʾ��
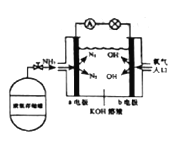
��b�缫�ĵ缫��Ӧʽ��_________��
��һ��ʱ�������װ���в���KOH�������ݷ�Ӧԭ������ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ����ܰ���ͼ����������ʾ��Ӧһ����ɣ���ϵת������
ѡ�� | a | b | c |
|
A | Cu | CuO | Cu(OH)2 | |
B | SiO2 | Na2SiO3 | H2SiO3 | |
C | AlCl3 | NaAlO2 | Al(OH)3 | |
D | CaO | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ����Ȼ���Һ���װ�á���֪�����Ȼ����۵�Ϊ-70�棬�е�57.6�棬��ˮ����Ӧ��

��ش��������⡣
��1��д��װ��A�з�����Ӧ�Ļ�ѧ����ʽ_______________________________
��2��װ��B��ʢ�ŵ��Լ���____________��װ��C��������___________
��3��g�ܵ�������_________________________________
��4��װ��E�б�ˮ��������_________________________________________
��5�������F�м�ʯ�ҵ�������___________________��________________________
��6����Ҫ��װ��B��C����װ��F����װ��B��C��Ӧʢ�ŵ��Լ��ֱ���_____��__________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com