

分析 Ⅰ.(1)Na2S与氯气反应生成S沉淀,S与S2-结合生成多硫离子;
(2)在足量氯水中,氯气与硫离子反应生成硫酸根离子,加盐酸酸化的BaCl2溶液生成硫酸钡沉淀;
Ⅱ.(1)①SO2(g)+PCl5(s)?SOCl2(I)+POCl3(I)△H1=akJ/mol
②PCl5(s)+H2O(I)?POCl3(I)+2HCl(g)△H2=bkJ/mol
依据盖斯定律计算②-①得到;
(2)实验室将CaSO3和PCl5按物质的量之比1:2混合,微热,两者正好完全反应制得SOCl2,同时生成氯化钙和POCl3,结合原子守恒配平书写化学方程式,生成的SOCl2和AlCl3•6H2O混合共热制取无水AlCl3,是利用SOCl2与结晶水反应生成SO2与HCl抑制铝离子的水解;
(3)容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行,容器Ⅱ、Ⅲ是恒温恒容,反应从正逆反应分析进行达到相同的平衡状态,
①绝热容器中,随反应进行温度升高,反应速率增大,达到平衡所需时间短;
②若容器Ⅱ恒温恒容,容器Ⅰ是恒温恒容时,达到相同平衡状态,二氧化硫转化率和SO2Cl2的转化率之和为1,实际容器Ⅰ是绝热恒容,随着反应的进行,温度升高,平衡逆向进行,二氧化硫转化率减小;
③用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结合三行计算得到.
解答 解:Ⅰ.(1)在浓Na2S溶液中滴入少量氯水,Na2S与氯气反应生成S沉淀,S与S2-结合生成多硫离子,所以没有沉淀生成,其溶液中发生的反应为:S2-+Cl2=2Cl-+S↓,(n-1)S+S2-=Sn2-;
故答案为:S2-+Cl2=2Cl-+S↓;(n-1)S+S2-=Sn2-;
(2)在足量氯水中,滴入少量Na2S溶液,氯气与硫离子反应生成硫酸根离子,即S2-+4Cl2+4H2O=8Cl-+SO42-+8H+,所以没有沉淀生成,再加盐酸酸化的BaCl2溶液生成硫酸钡沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓;
故答案为:S2-+4Cl2+4H2O=8Cl-+SO42-+8H+;Ba2++SO42-=BaSO4↓;
Ⅱ.(1)①SO2(g)+PCl5(s)?SOCl2(I)+POCl3(I)△H1=akJ/mol
②PCl5(s)+H2O(I)?POCl3(I)+2HCl(g)△H2=bkJ/mol
依据盖斯定律计算②-①得到SOCl2与H2O反应的热化学方程式:SOCl2(I)+H2O(I)?SO2(g)+2HCl(g)△H=(b-a)KJ/mol,
故答案为:SOCl2(I)+H2O(I)?SO2(g)+2HCl(g)△H=(b-a)KJ/mol;
(2)实验室将CaSO3和PCl5按物质的量之比1:2混合,微热,两者正好完全反应制得SOCl2,同时生成氯化钙和POCl3,结合原子守恒配平书写化学方程式CaSO3+2PCl5=SOCl2+CaCl2+2POCl3,生成的SOCl2和AlCl3•6H2O混合共热制取无水AlCl3,是利用SOCl2与结晶水反应生成SO2与HCl抑制铝离子的水解;
故答案为:CaSO3+2PCl5=SOCl2+CaCl2+2POCl3,SOCl2与结晶水反应生成SO2与HCl,HCl抑制Al3+水解;
(3)①绝热容器中,随反应进行温度升高,反应速率增大,达到平衡所需时间短,容器Ⅰ和容器Ⅲ达到平衡所需时间tⅠ<t2,
故答案为:<;
②若容器Ⅱ恒温恒容,容器Ⅰ也是恒温恒容时,达到相同平衡状态,二氧化硫转化率和SO2Cl2的转化率之和为1,但实际容器Ⅰ是绝热恒容,随反应进行温度升高,平衡逆向进行,二氧化硫转化率减小,因此容器Ⅰ中SO2的转化率与容器Ⅱ中SO2Cl2的转化率之和小于1,故答案为:<;
③用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结合三行计算得到,设反应二氧化硫物质的量为x
SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
起始量(mol) 1 1 0
变化量(mol) x x x
平衡量(mol) 1-x 1-x x
压强之比等于物质的量之比:$\frac{2}{2-x}$=$\frac{1}{0.75}$
x=0.5mol,
平衡常数K=$\frac{0.75×\frac{0.5}{2-0.5}}{0.75×\frac{1-0.5}{2-0.5}×0.75×\frac{1-0.5}{2-0.5}}$=4atm-1,
故答案为:4atm-1.
点评 本题考查了热化学方程式书写、氧化还原反应分析、盐类水解原理、影响化学平衡的因素、平衡常数计算等知识点,掌握基础是解题关键,题目难度中等.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:解答题
 草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 22.32 | 24.39 | 24.41 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
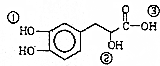
| A. | 该有机物的分子式为C9H10O5 | |
| B. | 该有机物能发生缩聚、加成、消去、氧化反应 | |
| C. | 1mol该有机物最多可以和4molNaOH发生反应 | |
| D. | 该有机物分子中①、②、③3个-OH的酸性由强到弱的顺序是③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Br>Se>Cl | B. | 热稳定性:HF>HCl>H2S | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.8g乙烯含有的共用电子对的数目为0.5NA | |
| B. | 标准状况下,将11.2LCl2通入足量的氢氧化钠溶液中制备漂白液,转移的电子数为NA | |
| C. | VLamol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA | |
| D. | T℃时,1LpH=6的纯水中,含有的OH-的数目为1.0×10-8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
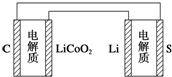 已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生氧化反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 下图表示用锂硫电池给锂离子电池充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(H+)•c(OH-) | C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
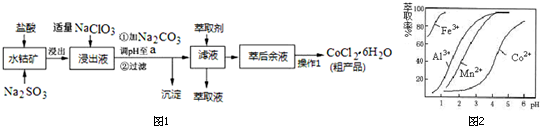
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com