
【题目】磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构简式如图所示,关于该有机物下列说法错误的是( )
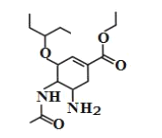
A.分子式为![]()
B.该有机物既能与酸反应又能与碱反应
C.该有机物分子中含有3个手性碳原子
D.1mol 该有机物最多能与3mol![]() 发生加成反应
发生加成反应
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时 H2A 的pKa1=1.85,pKa2=7.19。常温下,用 0.1mol·L-1NaOH 溶封液滴定 20 mL 0.1 mol·L-1H2A 溶液的滴定曲线如图所示。下列说法不正确的是

A.A 点 V0﹤10 mL线
B.B 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C.C 点所得溶液中:c(A2-)=c(HA-)
D.D 点所得溶液中:A2-水解平衡常数Kh1=10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是制备精盐的实验方案,各步操作流程如下:

(1)第②步操作的目的是除去粗盐中的______(填化学式)。
(2)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、___(填化学式)。
(3)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是________。
(4)写出第⑥步反应的离子方程式_______________,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和CO2是碳的两种氧化物,请计算:
(1)在标准状况下,5.6LCO的物质的量是__________,质量是__________。
(2)11gCO2在标准状况下的体积是__________。
(3)相同物质的量的CO和CO2所含氧原子个数之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将112mLCl2(标准状况)通入5mL1mol/L的FeBr2溶液中(还原性:Fe2+大于Br-),发生反应的离子方程式是( )
A.Cl2+2Br-=2Cl-+Br2B.2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
C.2Fe2++Cl2=2Fe3++2Cl-D.2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取三份各100mL该溶液分别进行如下实验:
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成;
(2)在另一份溶液中加入足量的NaOH溶液并加热,收集到1.12L气体(标准状况下);
(3)在第三份溶液中加入足量的BaCl2溶液有沉淀生成,经称量其质量为6.27g,在该沉淀中 加入足量的盐酸,沉淀部分溶解,剩余固体质量为2.33g。
根据上述实验回答下列问题:
①溶液中一定不存在的离子是:_______________________________;
②溶液中一定存在的阴离子有:_______________;其物质的量浓度分别为:_____________;
③推断K+是否存在:(填“是 ”或“否”)________________,其物质的量浓度为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zewail创立的飞秒(![]() )化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如
)化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如![]() 与
与![]() 的反应过程片段为:
的反应过程片段为:![]() 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A.中间产物![]() 属于有机化合物
属于有机化合物
B.反应起点为![]() 离解为H和I自由基,终点为
离解为H和I自由基,终点为![]() 自由基与I自由基结合
自由基与I自由基结合
C.![]() 经1000fs离解为
经1000fs离解为![]() 自由基和
自由基和![]() ,说明
,说明![]() 与
与![]() 的反应速率极快
的反应速率极快
D.飞秒化学展现的反应历程为“化学反应实质是旧键断裂和新键形成”提供有力证据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.1 mol羟基(-OH)中含7NA个电子
B.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.6.2g白磷(分子式为P4)中所含P—P键的数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com