
【题目】NaOH和盐酸都是中学化学常见的试剂
(一)某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度
(1)将5.0g烧碱样品( 杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,用________式滴定管量取,下图是某次滴定时的滴定管中的液面,其读数为________ mL。

(2)由下表数据, NaOH的百分含量是________。
滴定次数 | 待测NaOH溶液体积(mL) | 标准盐酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(3)用标准盐酸滴定某浓度的NaOH溶液,下列操作可能使测定结果偏高的是(_____)
A.用蒸馏水洗锥形瓶后,直接取10.00 mL待测液注入锥形瓶中
B.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
D.对酸式滴定管,滴定前正确读数,滴定后俯视读数
(二)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:

(4)从实验装置上看,图中缺少的一种玻璃用品是__________。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将________( 填“偏大”、“偏小”或“无影响”)。
(5)已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:_______________。
(三)常温时,向盛有0.1 mol·L-1Mg2+溶液的试管中滴加适量的NaOH溶液,到pH为11.0时(已知Ksp Mg(OH)2=5.61×1012)
(6)此时上层清液中c(Mg2+)=________ mol·L-1
【答案】 碱 22.60 80.0%(或80%) B C 环形玻璃搅拌棒 偏大 NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 5.61×106
【解析】(1)待测液是碱性溶液,应用碱式滴定管量取,根据图示,其读数为22.60 mL,故答案为:碱;22.60;
(2)两次消耗的标准液的体积分别为:20.10mL,19.90mL,两次滴定数据都是有效的,所以消耗标准液平均体积为20.00mL,根据c(待测)=![]() =
=![]() =0.4000molL-1,NaOH的物质的量=0.4000molL-1×0.25L×40g/mol=4.0g,NaOH的百分含量=
=0.4000molL-1,NaOH的物质的量=0.4000molL-1×0.25L×40g/mol=4.0g,NaOH的百分含量=![]() ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;
(3)A.锥形瓶水洗后未干燥,待测液的物质的量不变,标准液体积不变,测定值不变,故A错误;B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,标准液浓度偏小,会导致测定标准液体积偏高,测定值偏高,故B正确;C.酸式滴定管尖嘴部分有气泡,滴定后消失,会导致测定标准液体积偏大,测定值偏高,故C正确;D.滴定终点读数时俯视读数,会导致测定标准液体积偏小,测定值偏低,故D错误;故选BC;
(4)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,如改用0.0275 mol NaOH固体与该盐酸进行实验,氢氧化钠固体溶解放热,导致测得的“中和热”数值偏大,故答案为:环形玻璃搅拌棒;偏大;
(5)稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,则NaOH溶液和盐酸反应表示中和热的热化学方程式为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.3 kJmol-1;故答案为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.3 kJmol-1;
(6)常温时,向盛有0.1 mol·L-1Mg2+溶液的试管中滴加适量的NaOH溶液,到pH为11.0时,c(OH-)=1×103 mol/L,c(Mg2+)=![]() =
=![]() =5.61×106,故答案为:5.61×106。
=5.61×106,故答案为:5.61×106。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池B.锌锰干电池中,锌电极是负极
C.甲醇燃料电池可把化学能转化为电能D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)氯原子的结构示意图为_____________________。
(2)![]() 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。
(3)49g硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO42— 物质的量浓度__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体。回答下列问题:

(1)碘化亚铁溶液的制备:将碘和铁粉按物质的量之比在![]() 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2,在40-60℃下搅拌反应30-50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液。
①配料中铁粉过量的目的是____________;持续通入N2的目的是___________。
②检验反应液中不含碘单质的方法是___________。
(2)碘化钠溶液的制备:将制备好的碘化亚铁溶液加入碳酸氢钠溶液中,控制碘化亚铁与碳酸氢钠的物质的量之比在![]() ,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
,在80-100℃下,反应30-50 min,反应生成碘化钠及硫酸亚铁等。该反应的化学方程式为____________。
(3)点化钠的提纯与结晶:
①除去碘化钠溶液中以HCO3-的方法是____________。
②从碘化钠溶液中获得碘化钠晶体(20℃时溶解度为179/100g水,100℃时溶解度为302/100g水)的操作方法是________________。
(4)碘化钠的提度的测定:
该小组同学称取制得的碘化钠晶体18.1g,溶于水后加入50mL2.5mol/LAgNO3溶液,过滤、洗涤、干燥,称得沉淀的质量为28.2g。则碘化钠晶体的纯度为_________。(杂质不参与反应,结果保留至小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢气是一种清洁能源,其来源可以是:
途径1.用太阳能分解水生成氢气 途径2.用聚焦太阳能反应器发生以下反应:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
已知:在25℃、101kPa时 2CO(g)+ O2 (g) ===2CO2(g) ΔH=-566.0 kJ·mol-1
(1)在25℃、101kPa时,1克H2完全燃烧生成气态水时放热120.9kJ热量。补全该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH =_________
(2)已知拆开与形成1mol化学键需要相同的能量,途径2中,拆开1mol H-H键需能量是ckJ、1molH-O键是bkJ、1mol C-H键是akJ,则拆开1mol CO(g)化学键需要能量是_______kJ (用含字母的式子表示)
(3)CH4燃烧生成CO2和气态H2O的热化学方程式为__________
II.用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。
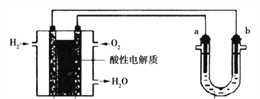
(4)燃料电池工作时,正极反应为:______________。
(5)U型管中装CuSO4溶液时,a、b两极均是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积比是:________。
(6)U型管中装饱和NaCl水溶液时,电解总反应的离子方程式是______________。
(7)用惰性电极电解M(NO3)x的水溶液,当阴极上增重m克时,在阳极上同时产生nL氧气(标准状况),从而可知M的相对原子质量是_________。(用含字母的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A.元素周期表有7个周期,8个主族
B.元素周期表有18个纵行,共16个族
C.短周期元素中可能有副族元素
D.最外层电子数相同的元素一定在同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。

下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:① Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式____________________________________,所加40%NaOH不宜过量太多的原因是______________________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_________________,反应后从剩余溶液中分离出CH3OH的实验方法是_____________。
(3)使用下列用品来测定溶液的pH,合理的是_________(填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体 _______________________,蒸发浓缩,__________,过滤, ______________,低温干燥,得到CrCl3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】读下图,按要求作答。

(1)写出下图所指仪器的名称:
a._______________b._______________
(2)改正上图蒸馏装置中的错误之处: ______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com