
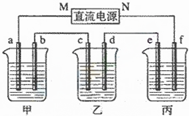
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.85%的NaCl溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.分析 (1)①乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极,以此可确定其它电极和电源的正负极;
②甲池中a为阴极,溶液中氢离子得到电子生成氢气,b为阳极,溶液中氯离子失电子发生氧化反应生成氯气,依据溶液中氯离子物质的量判断放电后电子转移和放电的离子,乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,计算电子转移,结合电子守恒计算;
③f为阳极,溶液中氢氧根离子失电子生成氧气;
④甲中相当于电解水和氯化钠,生成NaOH,溶液中氢氧根离子的浓度增大,pH变大.乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小.丙中为电解水,对于K2SO4而言,其pH几乎不变;
(2)乙中阴极为Cu2+放电,阳极为OH-放电,电解方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,生成的溶液中有电解质硫酸,电解硫酸溶液也可以使电解进行.
解答 解:(1)①乙中c电极质量增加,应为电解池的阴极,发生Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极,
故答案为:正;
②甲池中a为阴极,溶液中氢离子得到电子生成氢气,b为阳极,溶液中氯离子失电子发生氧化反应生成氯气,2Cl--2e-=Cl2↑,乙中c电极质量增加16g为析出的铜,物质的量n(Cu)=$\frac{16g}{64g/mol}$=0.25mol,c处发生的反应为:Cu2++2e-=Cu,计算电路中电子转移0.25mol×2=0.5mol,盛放100g 5.85%的NaCl溶液中氯化钠物质的量=$\frac{100g×5.85%}{58.5g/mol}$=0.1mol,结合电子守恒计算,电极b发生电极反应:2Cl--2e-=Cl2↑,生成氯气0.05mol,电子转移0.1mol,所以氯离子全部放电后溶液中氢氧根离子放电生成氧气,电子转移=0.5mol-0.1mol=0.4mol,电极反应4OH--4e-=2H2O+O2↑,生成氧气为0.1mol,
标况下的体积=(0.1mol+0.05mol)×22.4=3.36L,
故答案为:3.36L;
③f为阳极,溶液中氢氧根离子失电子生成氧气,电极方程式为:4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
④甲中相当于电解水和氯化钠,生成NaOH,溶液中氢氧根离子的浓度增大,pH变大,甲碱性增强;乙中阴极为Cu2+放电,阳极为OH-放电,电解方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,所以H+增多,故pH减小,乙酸性增强;丙中为电解水,对于K2SO4而言,其pH几乎不变,丙酸碱性不变,
故答案为:碱性增强;酸性增强;酸碱性不变;
(2)乙中阴极为Cu2+放电,阳极为OH-放电,电解方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,当铜全部析出后,通电电解时电解硫酸溶液,电解可以继续进行,故答案为:能; H2SO4;
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的钠在等物质的量的Cl2和O2中分别燃烧转移电子数 | |
| B. | 等物质的量的KO2与CaO2分别与水反应生成O2的体积(相同条件下) | |
| C. | 100mL 1mol/L HNO3分别与1.4g Fe、2.8gFe完全反应时生成 的NO物质的量 | |
| D. | 等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量气体时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温高压 | B. | 低温低压 | C. | 高温高压 | D. | 使用合适催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
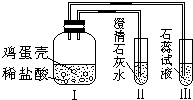 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | 鸡蛋壳发生了分解反应 | |
| B. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| C. | II中的澄清石灰水变浑浊 | |
| D. | III中紫色石蕊试液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12:7 | B. | 3:1 | C. | 1:3 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com