
��������泥�NH2COONH4����һ�ְ�ɫ���壬�ֽ⡢��ˮ�⣬���������ϡ�������ϴ�Ӽ��ȡ�ij��ѧ��ȤС��ģ�ҵԭ���Ʊ���������泥�
��Ӧ�Ļ�ѧ����ʽ���£�2NH3(g)+CO2(g)  NH2COONH4(s) ��H��0
NH2COONH4(s) ��H��0
��1��������ͼװ����ȡ����������ѡ����Լ��� ��

��2���Ʊ���������淋�װ������ͼ��ʾ���Ѱ����Ͷ�����̼ͨ�����Ȼ�̼�У����Ͻ����ϣ����ɵİ��������С�������������Ȼ�̼�С���������϶�ʱ��ֹͣ�Ʊ���
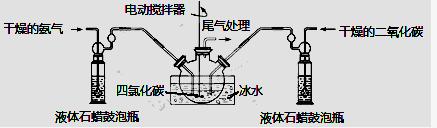
ע�����Ȼ�̼��Һ��ʯ����Ϊ���Խ��ʡ�
�ٷ������ñ�ˮ��ȴ��ԭ���ǣ� �� ��Һ��ʯ������ƿ�������ǣ� ��
�ڴӷ�Ӧ��Ļ�����з������Ʒ��Ϊ�˵õ������Ʒ��Ӧ��ȡ�ķ�����_______ ����дѡ����ţ���
a.��ѹ���Ⱥ�� b.��ѹ���Ⱥ�� c.���40 �����º��
��β������װ������ͼ��ʾ��˫ͨ�����ܵ����ã� ��
Ũ��������ã� �� ��
��3��ȡ�ֱ��ʶ�����̼����淋İ����������Ʒ11.73 g��������ʯ��ˮ ��ִ�����ʹ̼Ԫ����ȫת��Ϊ̼��ƣ����ˡ�ϴ�ӡ�����������Ϊ15.00 g������Ʒ�а�������淋����ʵ�������Ϊ ��
[Mr(NH2COONH4)=78g/mol��Mr(NH4HCO3) =79 g/mol��Mr(CaCO3)=100 g/mol]����.Դ��ȫ,��
��֪ʶ�㡿����ʵ��������衢ʵ�鷽�������������
���𰸽����� ��1��Ũ��ˮ���������ƹ��� ��CaO����ʯ�ң��Ⱥ����𰸣�2�֣�
��2���ٽ�����߷�Ӧ����ת���ʣ����¶ȣ���ֹ��Ӧ������ɲ���ֽ⣩��2�֣�
ͨ���۲����ݣ�����NH3��CO2ͨ�������2�֣�
�ڹ��ˣ�2�֣� C ��2�֣�
�۷�ֹ������1�֣����ն��ఱ����ֹ������ˮ�������뷴Ӧ��ʹ���������ˮ�⣨2�֣�
��3��80% �� 4/5��0.8������������֣���2�֣�
��������1��װ��1�����÷�Һ©������Һ���ܽ���ƿ�еĹ��壬�����ܽ����ʹ��ˮ�ֽ����ɰ�������Ũ��ˮ�μӵ����������ƻ��������ƣ����ܽ�����з���ʹŨ��ˮ�ֽ����ɰ�������2���ٷ�Ӧ2NH3��g��+CO2��g��⇌NH2COONH4��s��+Q���Ƿ��ȷ�Ӧ������ƽ��������У��¶����ߣ��������ñ�ˮ��ȴ��߷�Ӧ����ת���ʣ���ֹ�������¶ȹ��߷ֽ⣬Һ��ʯ������ƿ�������ǿ��Ʒ�Ӧ���г̶ȣ������������ٺ�ԭ���������ȣ����Ʊ���������淋�װ����ͼ��ʾ���Ѱ����Ͷ�����̼ͨ�����Ȼ�̼�У����Ͻ����ϣ����ɵİ��������С�������������Ȼ�̼�У������Ʒ��ʵ�鷽�����ù��˵õ�����������泥�NH2COONH4����һ�ְ�ɫ���壬�ֽ⡢���ܼ��Ⱥ�ɣ�Ӧ�����40�����º�ɣ���˫ͨ�����ܵ������Ƿ�ֹҺ�嵹����Ũ���������ն���İ�����ͬʱ��ֹ������ˮ�������뷴Ӧ��ʹ���������ˮ�⣻��3��ȡ�ֱ��ʶ�����̼����淋İ����������Ʒ11.73g��������ʯ��ˮ��ִ�����ʹ̼Ԫ����ȫת��Ϊ̼��ƣ����ˡ�ϴ�ӡ�����������Ϊ15.00g�����ʵ���Ϊ0.15mol������Ʒ�а�����������ʵ���Ϊx��̼��������ʵ���Ϊy������̼Ԫ���غ�õ���
x+y=0.15 ���x=0.12mol
78x+79y=11.73 y=0.03mol
����Ʒ�а�������淋����ʵ�������=0.12mol��0.15mol��100%=80%��
��˼·�㲦�����⿼���������Ʊ�ʵ������Ӧ�ã���Ҫ�ǰ������Ʊ�����������������Ʊ�ʵ��װ�÷����жϣ�ʵ��������������������ʵ����ƣ��йػ����ļ��㣬��Ŀ�Ѷ��еȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1����֪Na2S2O3��H2SO4===Na2SO4��S����SO2����H2O����ͬѧͨ���ⶨ�÷�Ӧ����ʱ��Һ����ǵ�ʱ�䣬�о���������Ի�ѧ��Ӧ���ʵ�Ӱ�졣���ʵ������(��ȡ��Һ�����Ϊ10 mL)��
| ʵ���� | ʵ���¶�/�� | c(Na2S2O3) /mol·L��1 | c(H2SO4) /mol·L��1 |
| �� | 25 | 0.1 | 0.1 |
| �� | 25 | 0.2 | 0.1 |
| �� | 25 | 0.1 | 0.2 |
| �� | 50 | 0.2 | 0.1 |
| �� | 50 | 0.1 | 0.1 |
������������ʱ��̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��__________(��ʵ����)��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��__________(��ʵ����)����ͬʱѡ��٢ڢ���Һ����ǵ�ͬʱ��̽��__________�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
��2����֪Na2S2O3��Һ��Cl2��Ӧʱ��1 mol Na2S2O3ת��8 mol���ӡ��÷�Ӧ�����ӷ���ʽ��____________________________________________________________��
��ͬѧ�������ʵ������̽��Na2S2O 3�Ļ�ѧ���ʡ�
3�Ļ�ѧ���ʡ�
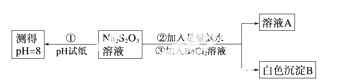
(��)��ͬѧ���ʵ�����̵�Ŀ����֤��Na2S2O3��Һ���м��Ժ�________�ԡ�
(��)����BaCl2��Һ���ɰ�ɫ����B�����ӷ���ʽ��________________________��
(��)��ͬѧ��ΪӦ�����������Тڢ������Լ�˳��ߵ�������Ϊ�ס�����ͬѧ����Ƹ���������________(��ס����ҡ�)��������______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�۲����о��������ʵ�һ�ֻ���������һͬѧ��һС�������¶���ڿ����У��۲쵽������������ɫ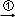 ��Ұ�
��Ұ� ���ɫ
���ɫ ����Һ��
����Һ�� ��ɫ���壬����˵����ȷ���ǣ�������
��ɫ���壬����˵����ȷ���ǣ�������
| �� | A�� | �ٷ�����������ԭ��Ӧ |
| �� | B�� | �ڱ��ɫ����Ϊ������̼���� |
| �� | C�� | ����̼�������տ����е�ˮ�����γ�����Һ |
| �� | D�� | ��ֻ���������仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ2H2S(g)  2H2(g)��S2(g)����H >0�������������䣬����˵����ȷ����
2H2(g)��S2(g)����H >0�������������䣬����˵����ȷ����
A�������������Ӧ·���������ı䣬��HҲ����֮�ı�
B�������¶ȣ����淴Ӧ���ʶ�����H2S�ֽ���Ҳ����
C������ѹǿ��ƽ�����淴Ӧ�����ƶ�����ϵ�¶Ƚ���
D��������ϵ������H2���´ﵽƽ���H2Ũ�Ƚ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
I�����¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol A��1.0 mol B��������ӦA(g)��B(g)  C(g)��һ��ʱ���ﵽƽ�⡣�ⶨ�ò������ݼ��±���
C(g)��һ��ʱ���ﵽƽ�⡣�ⶨ�ò������ݼ��±���
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
�ش��������⣺
(1)��Ӧǰ5 s��ƽ����Ӧ����v(A) ��____________
(2)�¶�ΪTʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ����
(3)�����¶ȣ�ƽ��ʱc(A)��0.41 mol��L��1����Ӧ�Ħ�H ���� ��>0�� �� ��<0����
(4)��ͬ�¶��£���ʼʱ�������г���0.2 mol A��0.2 mol B��1.0 mol C����Ӧ�ﵽƽ��ǰ����Ӧ����v�� v��������>�� �� ��<����
(5)���д�ʩ������Ӧ���ʣ���ƽ��������Ӧ�����ƶ��� ��
a����ʱ�����A���� b���ʵ������¶�
c������B��Ũ�� d��ѡ���Ч����
II��NO��NO2�dz������������H2��CO����ԭNO�ɴﵽ������Ⱦ��Ŀ�ġ�
��֪��2NO(g) = N2(g) + O2(g) ��H = -180.5kJ��mol-1
2H2O(l) = 2H2(g) + O2(g) ��H = +571.6kJ��mol-1
����H2����ԭNO������Ⱦ���Ȼ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʵ��Ŀ���ж�����ʵ�������װ����ȷ����
| Ŀ�� | A��������ͷȼ�� ������SO2 | B������ϡ���� ��Һ | C������Cl2��KBr ��Ӧ���ɵ�Br2 | D�����װ�� ������ |
| װ�� �� ���� |
|
|
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������Ҫ�ɷֿɱ�ʾΪFeO·Cr2O3��������MgO��Al2O3��Fe2O3�����ʣ��������Ը�����Ϊԭ���Ʊ��ظ���أ�K2Cr2O7��������ͼ��

��������ش��������⣺
��1��������������� ������X����Ҫ���� ����д��ѧʽ����
��2���ô��������ҺpH=7��8���ٽ��в��������ù���Y�ijɷ�Ϊ ��д��ѧʽ��.
��3���ữ�����е�����ҺpH��5ʱ������Ӧ2CrO42����2H+��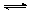 Cr2O72����H2O.����������������ᣬ�������Cr2O72����Ӧ��ɴ�����Ⱦ������Cr3+���ʣ��÷�Ӧ�����ӷ���ʽΪ .
Cr2O72����H2O.����������������ᣬ�������Cr2O72����Ӧ��ɴ�����Ⱦ������Cr3+���ʣ��÷�Ӧ�����ӷ���ʽΪ .
��4���±���������ʵ��ܽ�����ݣ�����III������Ӧ�Ļ�ѧ����ʽ��
Na2Cr2O7+2KCl=K2Cr2O7��+2NaCl���÷�Ӧ����Һ���ܷ����������ǣ� ��

��5��������������ˮ���������ŷŶ��������滷���м����Σ������ⷨ�Ǵ�������Ⱦ��һ�ַ�������������������ʯī��������⺬Cr2O72-�����Է�ˮ��һ��ʱ������Fe(OH)3��Cr(OH)3������
 �ٵ�ⷨ������ˮ���ܷ�Ӧ���£���ƽ����д��ȱ��(��֪������n(Fe(OH)3): n (H2)=1:1)
�ٵ�ⷨ������ˮ���ܷ�Ӧ���£���ƽ����д��ȱ��(��֪������n(Fe(OH)3): n (H2)=1:1)
___Fe��___Cr2O72-��___ ��___H2O ��___Fe(OH)3����___Cr(OH)3����___H2����
����֪������Cr(OH)3��Ksp=6.4��10–32mol4/l4����������������ˮˮ�ʱ������������ֵ��0.052 mg/L��Ҫʹ��Һ��c(Cr3+)������������ˮˮ�ʱ����������Һ��pH����______������֪lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ʵ�����ʱ��һ������²�Ӧ����Ӵ�����
A������Һ����ȡ10 mL NaOH��Һ��������ƿ�У���Һ�ܵļ������ƿ���ڱ�
B����ѹ����ʱ������©���¶˹ܿ�������ƿ���ڱ�
C��ʵ���ҽ�HCl��������ˮʱ�����۵�����©�������ձ��ڵ�ˮ��
D����Һ�����ֳ��²�Һ��ʱ����Һ©���¶˹ܿں��ձ����ڱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�������Ա�Ϊ��Ҫԭ�ϣ���������·�ߺϳ�����ҩ——������
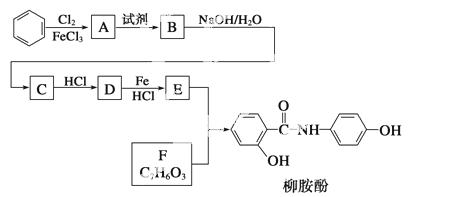
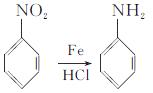
��֪��
�ش��������⣺
(1)���������ӣ�����˵����ȷ����________��
A��1 mol�����������Ժ�2 mol NaOH��Ӧ
B��������������Ӧ
C���ɷ���ˮ�ⷴӦ
D�������巢��ȡ����Ӧ
(2)д��A��B��Ӧ������Լ�________��
(3)д��B��C�Ļ�ѧ����ʽ_________________________________________��
(4)д��������F�Ľṹ��ʽ__ _____________________________________��
_____________________________________��
(5)д��ͬʱ��������������F��ͬ���칹��Ľṹ��ʽ__________________
______________________________________________________(�3��)��
�����������ұ����������ֲ�ͬ��ѧ��������ԭ�ӡ�
���ܷ���������Ӧ��
(6)�Ա�����ϩΪԭ�Ͽɺϳɾ۱���ϩ������ƺϳ�·��(���Լ����ܼ���ѡ)
ע���ϳ�·�ߵ���д��ʽ��������ʾ������ͼ��
CH3CHO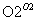 CH3COOH
CH3COOH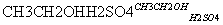
CH3COOCH2CH3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com