
| A. | 无色溶液中:Al3+、NH4+、Cl-、HCO3- | |
| B. | 甲基橙显红色的溶液中:Fe2+、Na+、SO42-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol•L-1的溶液:K+、HCO3-、I-、ClO- | |
| D. | pH值为1的溶液:Fe2+、Cl-、Na+、SCN- |
分析 A.铝离子与碳酸氢根离子发生双水解反应;
B.该溶液中存在大量氢离子,酸性条件下硝酸根离子能够氧化亚铁离子;
C.该溶液中存在大量氢离子或氢氧根离子,次氯酸根离子能够氧化碘离子,碳酸氢根离子、次氯酸根离子与氢离子反应;
D.该溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应.
解答 解:A.Al3+、HCO3-之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.甲基橙显红色的溶液呈酸性,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.水电离出来的c(H+)=10-12mol•L-1的溶液呈酸性或碱性,I-、ClO-之间发生氧化还原反应,HCO3-、ClO-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故C错误;
D.pH值为1的溶液中存在大量氢离子,Fe2+、Cl-、Na+、SCN-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
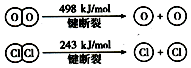 已知4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
已知4HCl(g)+O2(g) $?_{400℃}^{催化剂}$2Cl2(g)+2H2O(g)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池通入O2的电极反应为O2+4e-+4H+=2H2O | |
| B. | 乙池 Ag电极增重6.4g,溶液中将转移0.2mol电子 | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+Br2→CH3CHBr2 | |
| B. | CH3CH═CH2+Br2→CH3CHBrCH2Br | |
| C. | CH3CH═CH2+Br2→CH3CH2CHBr2 | |
| D. | CH2═CH-CH═CH2+Br2(足量)→CH2═CH-CHBr-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
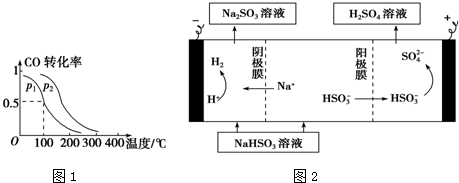
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com