
����Ŀ��Ԫ�����ڱ���ѧϰ���ʽṹ�����ʵ���Ҫ���ߣ���ͼ��Ԫ�����ڱ���һ���֣������Ԫ �آ٩����ڱ��е�λ�ûش��������⣮ 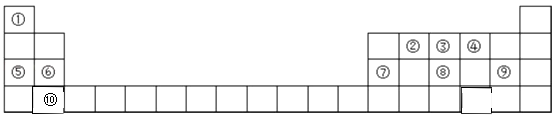
��1������ 10 ��Ԫ���У�ԭ�Ӱ뾶����������Ԫ�ط��ţ���
��2���ࡢ�������������Ӧˮ���������ǿ��˳���� �� ���ѧʽ��
��3��д�����γɵĵ��ʺ�ˮ��Ӧ�����ӷ���ʽ ��
��4��д���١���Ԫ����ɵĻ�����ĵ���ʽ���� ��
��5���ܢݢޢ߶�Ӧ�����Ӱ뾶��С�����������ӷ��ţ���
��6��д��ʵ������ȡ�۵���̬�⻯��Ļ�ѧ����ʽ ��
���𰸡�
��1��Ca
��2��HClO4��H3PO4
��3��Cl2+H2O=H++Cl��+HClO
��4��![]() ��
��![]()
��5��Al3+
��6��Ca��OH��2+2NH4Cl ![]() CaCl2+2NH3��+2H2O
CaCl2+2NH3��+2H2O
���������⣺��Ԫ��Ϊ���ڱ���λ�ÿ�֪���٩���ֱ�ΪH��C��N��O��Na��Mg��Al��P��Cl��Ca����1�����Ӳ�Խ�࣬ԭ�Ӱ뾶Խ�������� 10 ��Ԫ���У�ԭ�Ӱ뾶������Ca�����Դ��ǣ�Ca����2���ǽ�����Խǿ����Ӧ��ۺ����������Խǿ���ࡢ�������������Ӧˮ���������ǿ��˳����HClO4��H3PO4 �� ���Դ��ǣ�HClO4��H3PO4����3��������ˮ��Ӧ��������ʹ����ᣬ��ӦΪCl2+H2O=H++Cl��+HClO�����Դ��ǣ�Cl2+H2O=H++Cl��+HClO����4���١���Ԫ����ɵĻ�����ΪH2O��H2O2 �� ����ʽ�ֱ�Ϊ ![]() ��
�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ����5��������ͬ�����Ų��������У�ԭ������������Ӱ뾶С����ܢݢޢ߶�Ӧ�����Ӱ뾶��С����Al3+ �� ���Դ��ǣ�Al3+����6��ʵ������ȡ�۵���̬�⻯��Ļ�ѧ����ʽΪCa��OH��2+2NH4Cl
����5��������ͬ�����Ų��������У�ԭ������������Ӱ뾶С����ܢݢޢ߶�Ӧ�����Ӱ뾶��С����Al3+ �� ���Դ��ǣ�Al3+����6��ʵ������ȡ�۵���̬�⻯��Ļ�ѧ����ʽΪCa��OH��2+2NH4Cl ![]() CaCl2+2NH3��+2H2O�����Դ��ǣ�Ca��OH��2+2NH4Cl
CaCl2+2NH3��+2H2O�����Դ��ǣ�Ca��OH��2+2NH4Cl ![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��


 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ���Ҫ�ɷ���CaCO3������������SiO2��MgCO3��ɫ�ص����ʣ��ⶨ�����иƺ����IJ���������ͼ��ʾ:
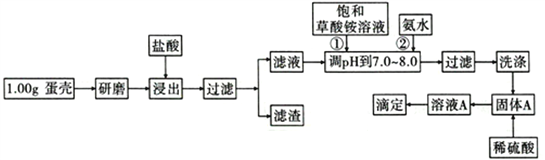
��֪��CaC2O4��MgC2O4��������ˮ��
�ش��������⣺
��1����Ʒ���������õ���������Ҫ��________________________________��
��2���٢ڲ���ʱ�����뱥��(NH4)2C2O4��Һ�Ͱ�ˮ��������_______________________��
��3��ϴ�����ѡ��_____(������ˮ������0. lmol/L�������Һ��)����Ŀ����____________________��
��4����һ���¶��£���2L���ܱ������з��������IJ���ƣ�������ռ������Բ��ƣ�������Ӧ: CaC204(s) ![]() CaO(s)+CO(g)+CO2(g)����ǰ5min ������ CaO ������Ϊ11.2g����ö�ʱ����v(CO)=_______��
CaO(s)+CO(g)+CO2(g)����ǰ5min ������ CaO ������Ϊ11.2g����ö�ʱ����v(CO)=_______��
��5���ζ��������ñ����Ը��������Һ�ζ����ɵIJ��ᣬͨ���������Ķ�����ϵ���ɼ������Ƶĺ����� ����1:����ҺA������ˮϡ����250mL��
����2:ȡϡ�ͺ����Һ25.00mL����ƿ�У���ϡH2SO4�ữ��
����3:��0.0190 mol��L-1KMnO4��Һ�ζ�����2������Һ���յ㣬����KMnO4��ҺV1mL��
����4���ظ�����2������3�IJ���3�Σ���¼�������±���
ʵ���� | KMnO4��Һ��Ũ�ȣ�mol /L) | KMnO4Һ����������mL) |
1 | 0.0190 | V1=20.02 |
2 | 0.0190 | V2= 20.00 |
3 | 0.0190 | V3=19.98 |
4 | 0.0190 | V4 = 20.80 |
��KMnO4��Һ�Ͳ�����Һ��ϡ�����з�Ӧ�����ӷ���ʽΪ____________________��
�ڵζ��յ��������________________________________________��
�۸õ�����CaCO3����������=_______%����˷���õĸƺ���_________ʵ��ֵ(����>����=������<��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڸ�ʵ�����������˵���������
A. ����ǰӦ��������ƿ�м���������ʯ
B. ȡ�ý�����ʱ���������Ӧ�Ż�ú����
C. ����ƿ������ˮϴ��������ɲ���ʹ��
D. ������ɫ��Ӧ����NaCl��KCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ����Һ�У����ܴ������������ ��
A. �������ܷų�H2����Һ�У�NH4+��Na+��Cl����Br��
B. ˮ�������c(H+)=10��13mol��L��1����Һ�У�Fe3+��K+��CO32����SO32��
C. �����£� Kw/c(H+)=0.1mol��L��1����Һ�У�Al3+��Na+��SiO32����HCO3��
D. ʹʯ�������Һ�У�Fe2+��K+��ClO����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��X��Ϊ������Ԫ���γɵ����������ͼ��ʾת����ϵ(����������ͷ�Ӧ������ȥ)����֪A�ɶ����ڷǽ���Ԫ����ɣ�B����Ư�����ҹ����ֽ⡣��ش���������:

��1����AΪ���ʣ���CΪһԪǿ�ᡣ
����ɵ���A��Ԫ����Ԫ�����ڱ��е�λ��Ϊ__________��
��д��һ�ֹ�ҵ�Ʊ�����A���������ӷ���ʽ: __________��
��X����Ϊ________(����ĸ����)��
a.NaOH b. AlCl3 c.Na2CO3 d.NaAlO2
��2����AΪ����Ԫ���γɵĻ������E��ˮ��Ӧ���ɵ�G��Ũ��Һ��C�а��̲�����
��A�ĵ���ʽΪ__________��
��A��H2O��Ӧ�Ļ�ѧ����ʽΪ__________��
��G��Ũ��Һ��C�������̵Ļ�ѧ����ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к͵ζ����ⶨij�ռ���Ʒ�Ĵ��ȣ��Ը���ʵ��ش��������⣺
��1��ȷ����8��2g�������������������ʵ���Ʒ�����500mL������Һ�� ��0��100mol![]() L-1����ζ���д�����кͷ�Ӧ���Ȼ�ѧ����ʽ____________(�к�����H����57��3 kJ/mol)�������ռ���Ʒ���500mL������Һ��Ҫ�IJ���������_________________________��
L-1����ζ���д�����кͷ�Ӧ���Ȼ�ѧ����ʽ____________(�к�����H����57��3 kJ/mol)�������ռ���Ʒ���500mL������Һ��Ҫ�IJ���������_________________________��
��3���ζ������У��۾�Ӧע��_________________�����÷�̪��ָʾ���ﵽ�ζ��յ���ɫ�仯��____________________________________��
��4�������±����ݣ����㱻���ռ���Һ�����ʵ���Ũ����_____molL-1���ռ���Ʒ�Ĵ�����____������С�������λ��
�ζ����� | ������Һ �����mL�� | ������� | |
�ζ�ǰ�Ŀ̶ȣ�mL�� | �ζ���Ŀ̶ȣ�mL�� | ||
��һ�� | 10��00 | 0��40 | 20��50 |
�ڶ��� | 10��00 | 4��10 | 24��00 |
��5������ʵ�������Եζ��������ʲô�����������ƫ������ƫ����������Ӱ������
�� �۲���ʽ�ζ���Һ��ʱ����ʼ���ӣ��ζ��յ�ƽ�ӣ���ζ����____��
�� ������ƿ�ô���Һ��ϴ��Ȼ���ټ���10��00mL����Һ����ζ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
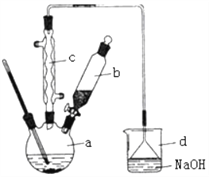
����Ŀ�������屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£�
�� | �� | �屽 | |
�ܶ�/g��cm-3 | 0.88 | 3.10 | 1.50 |
�е�/�� | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
�����²���ش����⣺
��1����a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mL Һ̬�塣��a�е��뼸���壬a��Һ���������ڣ����к���ɫ�������֣�a�з����Ļ�ѧ����ʽΪ_______________________�������μ���Һ����ꡣ����a��������___________װ��d�е�������_______________________������cΪ�����ܣ����ˮ��Ϊ__________________������������������������
��2��Һ�����������в�������ᴿ��
����a�м���10 mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10 mLˮ��8 mL10����NaOH��Һ��10 mLˮϴ�ӡ�NaOH��Һϴ�ӵ�������_______________________��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����_______________________��
��3��������������������屽�л����е���Ҫ����Ϊ____��Ҫ��һ���ᴿ�����в����б������____��
A���ؽᾧ B������ C������ D����ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ռ�Ӧѡ�õ�������( )
A.ʯӢ����
B.��ͨ��������
C.��������
D.�մ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com