
 .它是由乙烯和对二甲苯经过一系列反应后的产物缩聚而成的,则合成过程中乙烯与对二甲苯的物质的量之比为( )
.它是由乙烯和对二甲苯经过一系列反应后的产物缩聚而成的,则合成过程中乙烯与对二甲苯的物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 3:1 |
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:推断题
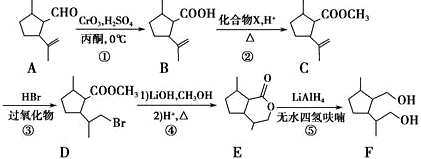
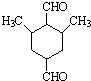 .
.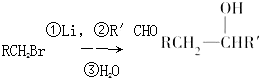
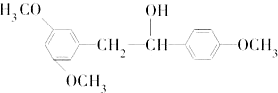 是合成抗癌药物白黎芦醇的中间体,请写出以
是合成抗癌药物白黎芦醇的中间体,请写出以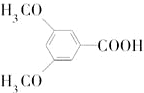 、
、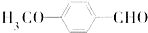 和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
和CH3OH为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: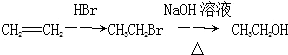
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质熔点:Z>W | B. | 离子半径:X<Y | ||
| C. | X和Z可存在于同一离子化合物中 | D. | 氧化物对应水化物的酸性X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
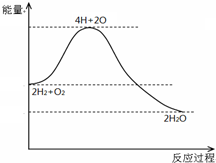
| A. | H2与O2反应是放热反应 | |
| B. | 断开化学键要放出能量 | |
| C. | 化学反应伴随着物质变化和能量变化 | |
| D. | 2mol H2和1mol O2具有的总能量高于2mol H2O 的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
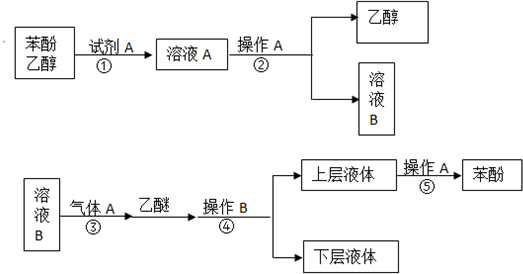
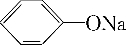 +CO2+H2O→NaHCO3+
+CO2+H2O→NaHCO3+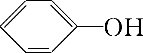 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑦ | B. | 只有⑦ | C. | ②④⑤⑦ | D. | ⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S | |
| C. | 邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 | |
| D. | 若X+和Y2-的核外电子层结构相同,则原子序数:Y<X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉 | B. | 醋酸锌溶液 | C. | 氯化铜固体 | D. | 二氧化锰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com