
【题目】下列物质中,属于电解质的是
A. 稀硫酸 B. 氯化钠 C. 乙醇 D. 铝
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】(I)工业上常用电解饱和食盐水的方法制备氯气,其装置如下图所示:

(1)写出电解饱和食盐水的化学方程式并在化学方程式上标出电子转移的方向和数目:_____。
(2)电解时,将Y极(阳极)生成的物质通入盛有NaI溶液的试管中,再加入四氯化碳充分振荡,最后观察到的现象是____________。
A.溶液分层,上层无色,下层橙红色
B.溶液分层,上层橙红色,下层无层
C.溶液分层,上层无色,下层紫红色
D.溶液分层,上层紫红色,下层无层
(3)用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式_______;____________________________。
(II)某同学对实验室制取氯气的装置进行改进,设计了制取无水氯化铁的实验装置图(如下),将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:

(4)烧瓶中发生反应的化学方程式____________________;
(5)产生的气体通过B、C装置,可以得到干燥纯净的氯气,B瓶中的试剂是_____________;
(6)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因为______________________________________。
(7)玻璃管D中反应现象是_________________;写出反应方程式______________________。
(8)干燥管E中盛有碱石灰(CaO+NaOH),其作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于 F、Cl、Br、I 性质的比较,下列说法不正确的是( )
A. 单质的颜色随核电荷数的增加而加深 B. 沸点:I2 < Br2 < Cl2 <F2
C. 酸性:HIO4< HBrO4 < HClO4 D. 与氢气反应的剧烈程度:I2 < Br2 < Cl2 <F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是________________,属于电解质的是_________________。(填编号)
(2)节日焰火利用的是_________反应,城市射灯在夜空形成五颜六色的光柱,属于______效应。
(3)在 2Na2O2+2CO2===2Na2CO3+O2反应中,_________是还原剂,_________是氧化剂。若转移3mol电子,则所产生的O2在标准状况下的体积为_________。
(4)①除去铁粉中混用铝粉,选用的试剂为:___________;
②NaHCO3溶液中混有Na2CO3 选用的试剂为________________________;
③除去Na2CO3粉末中的NaHCO3 ,采用的方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,O、B、C、D分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
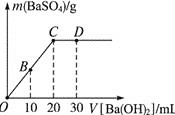
A. 硫酸溶液的体积为20 mL
B. B时刻溶液中SO42—的浓度约为0.125 mol·L-1
C. D时刻溶液为碱性
D. 溶液的导电能力:C<D<B<O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下足量金属锌与浓硫酸反应开始阶段生成硫酸锌、二氧化硫和水,反应进行到某个程度以后会发生另一个反应,请回答相关问题。
(1)请按反应的先后顺序写出前者的化学方程式和后者的离子方程式_____________________。
(2)整个过程中被还原的元素有 _________ 。(填序号)
(3)第一阶段反应中电子转移的情况 是_________ ![]() _________。(填元素符号)
_________。(填元素符号)
(4)若两个阶段反应的还原产物物质的量为1:1,则两个阶段转移电子数之比为________ 。
(5)检验最终所得溶液中主要阴离子的方法是 ________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
![]() ①
①
![]() ②
②
![]() ③
③
![]() ④
④
请回答下列问题
(1)这四个反应中属于氧化还原反应的有 ___________个。
(2)反应③中物质X的化学式是 _______________。
(3)反应④中氧化产物和还原产物依次是 ____、____。(填化学式)
(4)若反应③生成标准状况下的11.2L氧气,则转移电子数为 _____ 。
(5)反应②中所得混合气体的平均摩尔质量是 ____________ 。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主。已知砷化镓的晶胞结构如图。试回答:
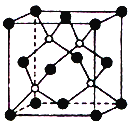
(1)镓的基态原子的外围电子排布式是_______________。
(2)镓与钾、钙元素的第一电离能从大到小依次为_________________________,与其在同一周期的砷、硒和溴的电负性从大到小依次为_______________。(填元素符号)
(3)此晶胞中所含的砷原子(白色球)个数为_______,与同一个镓原子相连的砷原子构成的立体构型为___________,镓采取的杂化方式为________________。
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为_____________________,其结构式为_____________,硼酸是_______元酸。
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为________cm,NA表示阿伏伽德罗常数,则该晶体的密度为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)Ba(OH)2:_______________________________________。
(2)KHSO4:________________________________________。
(3)HNO3:_________________________________________。
(4)Na2CO3:_______________________________________。
(5)NaHCO3:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com