
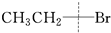


| A. | ①② | B. | ②③④ | C. | ①③ | D. | 全部 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
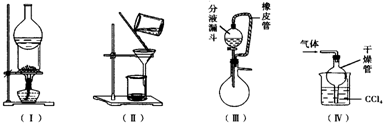 下列实验装置用途正确的是( )
下列实验装置用途正确的是( )| A. | 装置(Ⅰ)可用于I2与NH4Cl混合物的分离 | |
| B. | 装置(Ⅱ)用于分离Fe(OH)3胶体和FeCl3溶液 | |
| C. | 装置(Ⅲ)橡皮管起到平衡气压,使液体顺利流下的作用 | |
| D. | 装置(Ⅳ)用于吸收HCl或NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
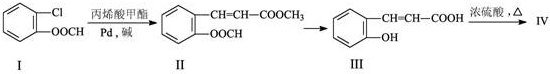
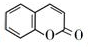
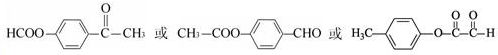
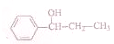 的化学方程式(无机试剂任选)
的化学方程式(无机试剂任选)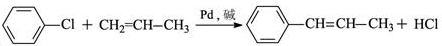 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷分子中的最多有5个原子在同一平面上 | |
| B. | 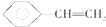 分子中最多有8个原子在同一平面上 分子中最多有8个原子在同一平面上 | |
| C. | CH2=CH-CH=CH2所有原子可能在同一直线上 | |
| D. | 2-丁烯(CH3CH=CHCH3)分子中4个碳原子可能在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Fe | H2O(g) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 乙酸(乙醇):加入金属钠,蒸馏 | |
| D. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:
我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com