
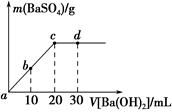
 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )| A. | 硫酸氢钠溶液的体积为10 mL | |
| B. | 溶液的导电能力:c<b<a | |
| C. | d时刻溶液的pH为13 | |
| D. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 |
分析 A.硫酸钡沉淀量达到最大量时的反应为:NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH,二者浓度相等,则硫酸根离子完全沉淀时两溶液的体积相等;
B.溶液中离子浓度越大其电解质溶液导电性越强;
C.d时刻,溶液中的溶质是NaOH和Ba(OH)2,计算出混合液中氢氧根离子的浓度,然后进行判断;
D.b时刻SO42-沉淀一半,体积变为原来的1.5倍,据此计算出此时溶液中硫酸根离子的浓度.
解答 解:A.硫酸根离子完全沉淀时的反应为:NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH,二者以1:1反应,且c(NaHSO4)=c[Ba(OH)2],硫酸钡完全沉淀时消耗两溶液体积相等,根据图象可知,加入氢氧化钡20mL时硫酸钡沉淀达到最大,所以V(NaHSO4)=V[Ba(OH)2]=20mL,故A错误;
B.a、b、d处的溶液中,根据反应NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH可知,反应过程中溶液各离子浓度减小,则溶液导电性逐渐减弱,即导电性:c<b<a,故B正确;
C.d时刻Ba(OH)2溶液过量10mL,溶液中同时含有氢氧化钠,则溶液中的c(OH-)=$\frac{0.25mol/L×0.01L×2+0.25mol/L×0.01L}{0.02L+0.03L}$mol/L=0.15mol/L>0.1mol/L,则溶液的pH≠13,故C错误;
D.b时刻SO42-沉淀一半,体积变为20mL+10mL=30mL,则溶液中SO42-的浓度约为:$\frac{0.25mol/L×0.02L×\frac{1}{2}}{0.03L}$mol/L=0.083mol•L-1,故D错误;
故选B.
点评 本题考查离子方程式的有关计算,为高频考点,题目难度中等,明确图中各点发生的反应及溶液中的溶质是解本题关键,难点是判断溶液导电能力大小,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中7个基本物理量之一 | |
| B. | 物质的量就是物质的质量 | |
| C. | 物质的量像一座桥梁,把物质的质量或体积等宏观量与微观粒子的数量联系起来 | |
| D. | 是表示物质数量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol•L-1 | |
| B. | 从1 L 2mol•L-1的H2SO4溶液中取出0.5L,剩余溶液的浓度仍为2mol•L-1 | |
| C. | 制成0.5L 10mol•L-1的盐酸,需标准状况下氯化氢气体112L | |
| D. | 中和100mL 1mol•L-1的H2SO4溶液,需NaOH的质量为4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含有 Cl2和 H2O 分子 | |
| B. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| C. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| D. | 新制氯水可使蓝色石蕊试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:2:1 | B. | 5:2:1 | C. | 15:3:2 | D. | 15:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com