
现有反应:
①CO+CuO Cu+CO2 ②MgO+2HCl=MgCl2+H2O
Cu+CO2 ②MgO+2HCl=MgCl2+H2O
③Cu+2AgNO3=Cu(NO3)2+2Ag ④CH4+2O2  CO2+2H2O
CO2+2H2O
⑤NH4HCO3 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
试回答:(1)上述属于置换反应的是______,属于复分解反应的是______.
(2)属于氧化还原反应的是______.
 Cu+CO2,该反应属于氧化还原反应;
Cu+CO2,该反应属于氧化还原反应; CO2+2H2O,该反应属于氧化还原反应;
CO2+2H2O,该反应属于氧化还原反应; NH3↑+CO2↑+H2O,该反应属于分解反应;
NH3↑+CO2↑+H2O,该反应属于分解反应;

科目:高中化学 来源: 题型:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| K1 |
| K2 |
| K1 |
| K2 |
| 各物质某一状态时的物质的量浓度/mol?L-1 | ||||||
| c(CO2) | c(H2 ) | c(CO) | c(H2O ) | Qc | 平衡 | |
| ① | 0.004 | 0.004 | 0.006 | 0.006 | 已达平衡 | |
| ② | 0.062 | 0.084 | 0.039 | 0.279 | 2.09 | |
| ③ | 0.182 | 0.086 | 0.098 | 0.359 | 2.25 | |
| ④ | 0.078 | 0.142 | 0.280 | 0.120 | 平衡逆向移动 | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
 CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.| k1 |
| k2 |
| k1 |
| k2 |
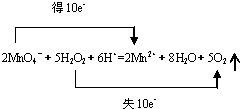

查看答案和解析>>
科目:高中化学 来源: 题型:

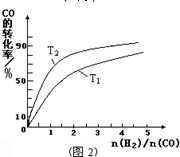

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
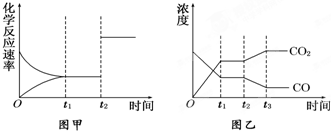
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器Ⅰ、Ⅱ中正反应速率相同 | B、容器Ⅰ、Ⅲ中反应的平衡常数相同 | C、容器Ⅰ中CO的物质的量比容器Ⅱ中的多 | D、容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com