
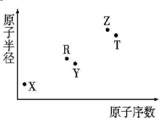
 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )| A. | X和Y组成的化合物的水溶液保存在塑料瓶中 | |
| B. | 原子半径和离子半径均满足:Y<Z | |
| C. | 最高价氧化物对应的水化物酸性:Z>T | |
| D. | 含Z元素的盐溶液一定显酸性 |
分析 由短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系图,R与X能形成X2R、X2R2化合物,可知X为H,R为O,结合原子序数大于O,原子半径小于O可知,Y为F元素;Z是地壳中含量最多的金属元素,Z为Al元素;T的原子序数大于Al,T原子最外层电子数是K层电子数的2倍,最外层电子数为4,则T为Si,以此来解答.
解答 解:由上述分析可知,X为H,Y为F,Z为Al,R为O,T为Si,
A.X和Y组成的化合物的水溶液为HF酸,与二氧化硅反应,则保存在塑料瓶中,故A正确;
B.电子层越多,原子半径越大,则原子半径Y<Z,而具有相同电子层结构的离子中原子序数大的离子半径小,则离子半径为Y>Z,故B错误;
C.非金属性Si>Al,则最高价氧化物对应的水化物酸性:Z<T,故C错误;
D.含Z元素的盐溶液,为偏铝酸钠时水解显碱性,为氯化铝时水解显酸性,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子半径、原子序数、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
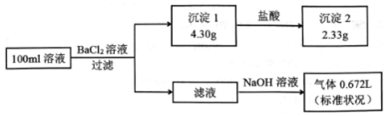
| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 是否存在Na+只有通过焰色反应才能确定 | |
| C. | 原溶液一定存在Na+,可能存在Cl- | |
| D. | 若原溶液中不存在Cl-,则c (Na+)=0.lmol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 加入试剂后发生反应 | |
| A | K+、Fe2+、I- | 少量的酸性KMnO4溶液 | 5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O |
| B | Fe3+、I-、SO42- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| D | Al3+、Cl-、NO3- | 过量浓氨水 | Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 实验目的 | 实验装置 | ||
| X | Y | Z | |||
| A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |  |
| B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
| C | NaCl | 浓硫酸 | AgNO3溶液 | 证明酸性:H2SO4>HCl | |
| D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
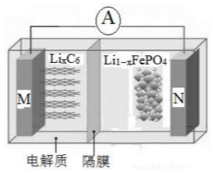 磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )| A. | 放电时Li+从右边移向左边 | |
| B. | 放电时M是负极,电极反应式为:C6x--xe-═6C | |
| C. | 充电时电路中通过0.5mol电子,消耗36gC | |
| D. | 充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-═Li1-xFeO4+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、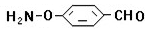 、
、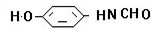 、
、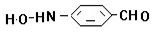 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com