
 .
. ,用电子式表示FM2的形成过程
,用电子式表示FM2的形成过程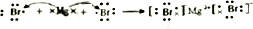 .
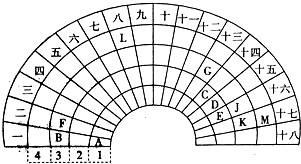
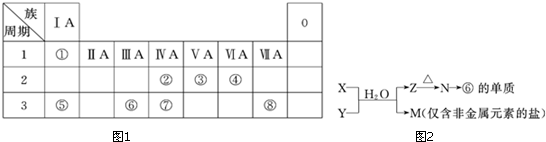
.分析 由位置可知,A为H,B为Na,C为C,D为N,E为O,F为Mg,G为Al,J为S、K为Cl,M为Br,L为Fe,
(1)E为O,G为Al,Al的离子核外有10个电子;
(2)DE2为CO2;FM2为MgBr2,为离子化合物;
(3)B和M形成的化合物为NaBr,与氯气反应生成溴,加四氯化碳发生萃取;
(4)同周期,从左向右金属性减弱,非金属性增强.
解答 解:由位置可知,A为H,B为Na,C为C,D为N,E为O,F为Mg,G为Al,J为S、K为Cl,M为Br,L为Fe,
(1)E位于第二周期第VIA族,Al的离子结构示意图为 ,故答案为:第二周期第VIA族;
,故答案为:第二周期第VIA族; ;
;
(2)DE2为CO2,其电子式为 ;BM2为MgBr2,为离子化合物,用电子式表示形成过程为
;BM2为MgBr2,为离子化合物,用电子式表示形成过程为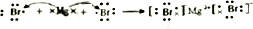 ,
,
故答案为: ;
;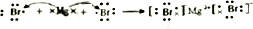 ;
;
(3)B和M形成的化合物为NaBr,与氯气反应生成溴,离子反应为Cl2+2Br-=Br2+2Cl-,加四氯化碳发生萃取,现象为下层溶液呈橙红色,
故答案为:Cl2+2Br-=Br2+2Cl-;下层溶液呈橙红色;
(4)同周期,从左向右金属性减弱,非金属性增强,则B、F、G三种元素最高价氧化物对应的水化物碱性最强的是NaOH;比较元素J、K的非金属性强弱,J的非金属性弱于K,并用化学方程式证明上述结论为Cl2+H2S=2HCl+S↑或 Cl2+Na2S=2NaCl+S↓,
故答案为:NaOH;弱;Cl2+H2S=2HCl+S↑或 Cl2+Na2S=2NaCl+S↓.
点评 本题考查元素的位置、结构与性质,为高频考点,把握短周期及扇形结构与现行周期表的对应关系推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律及元素化合物知识的应用,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:实验题
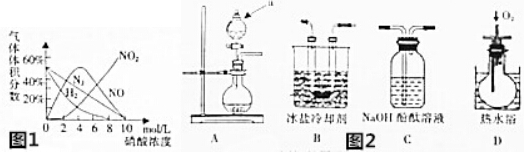
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
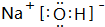 .
.| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R在化合物中显+1价 | B. | 最高价氧化物的水化物的碱性:X>R | ||
| C. | 原子半径:W<R<X | D. | R与Z可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
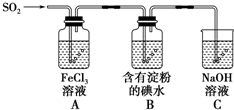 某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示
某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示查看答案和解析>>
科目:高中化学 来源: 题型:解答题
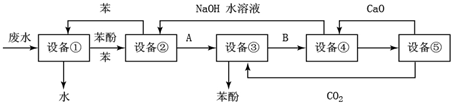 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
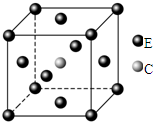 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com