
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
科目:高中化学 来源:2015届黑龙江省双鸭山市高一上学期期中考试化学试卷(解析版) 题型:填空题
(8分)水在很多的反应中,起到极其重要的作用。根据下面水参与的反应,回答问题:
① 2F2+2H2O==4HF+O2
②2Na2O2+2H2O== 4NaOH + O2↑
③2Na+2H2O==2NaOH+H2↑
④2H2O 2H2↑+O2↑
2H2↑+O2↑
(1)水只作氧化剂的是 ;(填写序号,下同)水只作还原剂的是 ;水既作氧化剂,又做还原剂的是 ;水既不是氧化剂,又不是还原剂的氧化还原反应是 。
(2)请标出下列反应的电子转移的方向和数目。3Cl2 +6 NaOH=5NaCl + NaClO3 + 3H2O
(3)上述反应3Cl2 + 6NaOH=5NaCl + NaClO3 + 3H2O若转移5mol电子,则所得氧化产物的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(解析版) 题型:填空题
(10分)四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
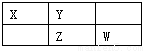
(1)元素Z位于周期表中第_______周期,_______ 族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________
(4)Y的最高价氧化物的水化物与其氢化物反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.NH4Cl的电子式: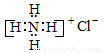
B.中子数为7的碳原子:7C
C.Cl-的离子结构示意图:
D.次氯酸的结构式:H-Cl-O
查看答案和解析>>
科目:高中化学 来源:2015届陕西省高二下学期期末考试化学试卷(解析版) 题型:选择题
有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是
A.在熔融电解质中,O2-由正极移向负极
B.电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷
C.电解池的阳极反应式为4OH--4e-===2H2O+O2↑
D.通入空气的一极是正极,电极反应式为O2+4e-===2O2-
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高三上期第一次月考理综化学试卷(解析版) 题型:实验题
(14分)某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:

该实验的主要操作步骤如下:
①配制100 mL 1.0 mol/L的盐酸溶液;
②用________(填仪器名称并注明规格)量取7.5mL 1.0 mol/L的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100 mL 1.0 mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏小(填写字母)____。
A 用量筒量取浓盐酸时,俯视量筒的刻度 B容量瓶未干燥即用来配制溶液
C浓盐酸在烧杯中稀释时,搅拌时间过长 D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线 F.烧杯中有少量水
(2)请填写操作步骤中的空格:步骤②_______________ 步骤③___________
(3)实验步骤⑤中应选用__________(填字母)的量筒。
A.100 mL B.200 mL C.500 mL
(4)读数时除恢复到室温外,还要注意①______________,②_____________________。
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____L/mol。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-)
B.某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)= c(Cl-)>c(H+)>c(OH-)
C.若2a mol·L-1HCN与a mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7
D.含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com