
| A. | Na2S | B. | S | C. | S02 | D. | H2SO4 |
分析 如果元素处于中间价态,则该元素既有氧化性又有还原性,如果处于最低价态,则只有还原性,如果处于最高价态,则只有氧化性,据此分析解答.
解答 解:如果元素处于中间价态,则该元素既有氧化性又有还原性,如果处于最低价态,则只有还原性,如果处于最高价态,则只有氧化性,
A.硫化钠中S元素为-2价,处于最低价态,只有还原性,故A正确;
B.S元素处于中间价态,既有氧化性又有还原性,故B错误;
C.二氧化硫中S元素为+4价,S元素处于中间价态,既有氧化性又有还原性,故C错误;
D.硫酸中S元素为+6价,处于最高价态,只有氧化性,故D错误;
故选A.
点评 本题以S元素为载体考查氧化还原反应,明确元素化合价与元素氧化性、还原性的关系是解本题关键,知道常见元素化合价.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用药匙取少许样品于试管中,用滴管滴加适量的3mol•L-1H2SO4溶液,加热,充分反应后得到A溶液 | - |
| 步骤2:取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 若溶液变红色,样品中含+3价的铁元素 |
| 步骤3:另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 若溶液的紫红色褪去,样品中含+2价的铁元素 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
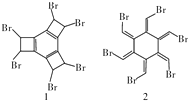
| A. | 有机物1和2互为同分异构体,分子式为C12H6Br6 | |
| B. | 有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应 | |
| C. | 有机物1和2中所有原子均共平面 | |
| D. | 有机物2能使酸性高锰酸钾溶液褪色,而有机物1不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
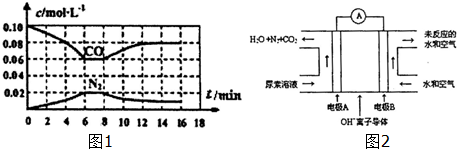
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
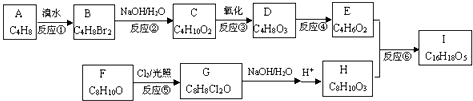
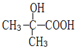 .
.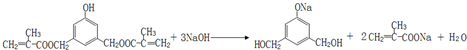 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水反应 | |
| B. | Ba(OH)2•8H20晶体与NH4Cl晶体的反应 | |
| C. | 硫酸与氢氧化钡溶液反应 | |
| D. | 煤的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
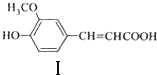 的说法,正确的是AB.
的说法,正确的是AB.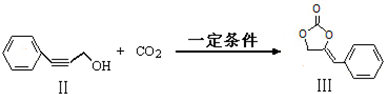
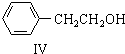 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$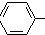 CH2CH2
CH2CH2 -CH2CH3+H2O
-CH2CH3+H2O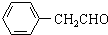 ;
;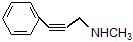 也可以和CO2发生类似反应①的反应,生成由VI,VI的结构简式为
也可以和CO2发生类似反应①的反应,生成由VI,VI的结构简式为 .
. .
.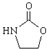 ,涉及的反应方程式为HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$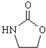 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
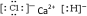 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 不同元素的原子构成的分子中只含极性共价键 | |
| C. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com