
| A. | 合理施用农药、化肥,以减少水体污染 | |
| B. | 洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所 | |
| C. | 将活性炭放入硬水中使其软化 | |
| D. | 加强工业废水的排放监控,坚持达标排放 |
分析 A、滥施滥用化肥、农药能够污染环境;
B、水的循环利用有利于节约水资源;
C、从活性炭能够吸附色素和异味考虑;
D、工业废水处理达标后再排放有利于保护环境.
解答 解:A、合理施用农药、化肥,可以减少水体污染,故A正确;
B、洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所,这样有利于节约水资源.故B正确;
C、活性炭能够吸附水中的色素和异味,不能除去水中的钙离子和镁离子.故C错误;
D、加强工业废水的排放监控,坚持达标排放有利于保护环境.故D正确.
故选C.
点评 本题考查了三废处理与环境保护,解答本题要充分理解节能环保的重要性,人人都要树立节能环保的理念,为保护环境贡献一份力量,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是NA | |
| B. | 常温常压下,4g氦气所含有的原子数目为NA | |
| C. | 标准状况下,1L己烷充分燃烧后生成的气态产物的分子数为$\frac{6}{22.4}$NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可做调味剂,也可做食品防腐剂 | |
| B. | 单质硅是制造太阳能电池和光导纤维的常用材料 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 聚乙烯塑料制品可用于食品的包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、CH4、N2等均是造成“温室效应”的气体 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 节能减排符合“低碳经济”的要求 | |
| D. | 合理开发利用“可燃冰”(固态甲烷水合物)有助于缓解能源紧缺 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硝酸可以鉴别毛织物和棉织物 | |
| B. | 葡萄糖和蔗糖不是同分异构体,但是同系物 | |
| C. | 羊毛完全燃烧只生成CO2和H2O | |
| D. | 某学生设计了如图实验方案用以检验淀粉水解的情况: 由以上实验可以得出淀粉已完全水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”给我们提供了水可以变油的证据 | |
| B. | CH4•(H2O)n属于氧化物 | |
| C. | “可燃冰”是燃烧值高,没有污染的新能源 | |
| D. | 开采不当可造成比二氧化碳更严重的温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚/nm | 0.05a | 0.2a | 0.45a | 0.8a | 1.25a |
| NiO层厚/nm | b | 2b | 3b | 4b | 5b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g/mol | |
| B. | 11.2L氯气所含的分子数为0.5NA | |
| C. | 0.1mol/L的Na2CO3溶液中所含Na+的物质的量为0.2mol | |
| D. | 常温常压下,1mol氦气含有的核外电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
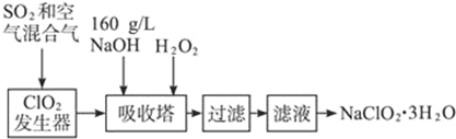
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com