
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 40.75 | B. | 29.38 | C. | 14.69 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 湿润的淀粉碘化钾试纸遇氯气变蓝色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va:Vb=9:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 判断如图装置的名称:B池为电解池(填“原电池”或“电解池”)当C2极析出224mL气体(标准状况)时:锌的质量减少(填“增加”或“减少”).
判断如图装置的名称:B池为电解池(填“原电池”或“电解池”)当C2极析出224mL气体(标准状况)时:锌的质量减少(填“增加”或“减少”).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
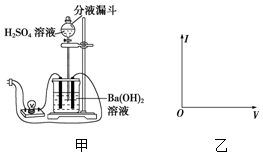 使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:
使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com