


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
| A、HF水溶液可存放在玻璃试剂瓶中 |
| B、Br2可从KCl溶液中置换出氯 |
| C、F、Cl、Br、I的非金属性依次减弱 |
| D、HF、HCl、HBr、HI的稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中氢氧根离子的浓度增大了 |
| B、c(CH3COOH)减小,电离平衡向生成醋酸分子的方向移动? |
| C、平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少 |
| D、电离程度增大,c(CH3COO-)也增大了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | XOH物质的量浓度(mol?L-1) | HCl物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学生设计的制取和收集某些气体的实验装置(可加热).
如图是某学生设计的制取和收集某些气体的实验装置(可加热).查看答案和解析>>
科目:高中化学 来源: 题型:
 A:在较高温度下和Br2按物质的量之比1:1发生加成反应的方程式:
A:在较高温度下和Br2按物质的量之比1:1发生加成反应的方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
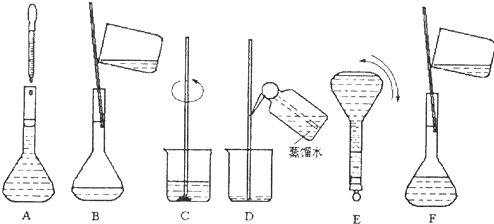
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com